
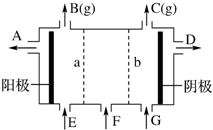
 现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽.用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液.下列说法中正确的是( )
现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽.用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液.下列说法中正确的是( )| A. | b是阳离子交换膜,允许Na+通过 | B. | 从A口出来的是NaOH溶液 | ||
| C. | 阴极反应式为4OH--4e-═2H2O+O2↑ | D. | Na2SO4溶液从G口加入 |
分析 电解饱和Na2SO4溶液时,阳极附近是OH-放电,生成氧气,阴极附近时H+放电生成氢气,由于装置中放置了离子交换膜,在两极分别生成NaOH和H2SO4,需在阳极室一侧放置阴离子交换膜,只允许通过阴离子,在阴极一侧放置阳离子交换膜,只允许通过阳离子,接电源正极的是阳极,即B放出氧气,C生成氢气,以此解答该题.
解答 解:A.阴极生成氢气和OH-,在阴极一侧放置阳离子交换膜,只允许通过阳离子,生成NaOH,故A正确;
B.A为阳极是氢氧根离子放电产生的气体是氧气,同时生成氢离子,则阳极附近生成硫酸,则从A口出来的是H2SO4溶液,故B错误;
C.阴极附近时H+放电生成氢气,反应式为2H++2e-═H2↑,故C错误;
D.NaOH在阴极附近生成,硫酸在阳极生成,则Na2SO4溶液从F口加入,故D错误.
故选A.
点评 本题考查电解池知识,为高频考点,本题设置新情景,即离子交换膜,注意根据两极上的反应判断生成物,有利于培养学生的分析能力和良好的科学素养,题目难度中等.


 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
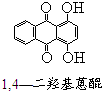 芳香族化合物A(C8H6O4)能与NaHCO3溶液反应生成CO2.由A与对二氯苯(
芳香族化合物A(C8H6O4)能与NaHCO3溶液反应生成CO2.由A与对二氯苯( )为原料经多步反应可合成1,4-二羟基蒽醌(结构如图所示).
)为原料经多步反应可合成1,4-二羟基蒽醌(结构如图所示). .
. $\stackrel{△}{→}$
$\stackrel{△}{→}$
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 甲 | 乙、丙、丁 |
| ① | 常见干燥剂 | 浓硫酸、石灰石、碱石灰 |
| ② | 常见合金 | 不锈钢、青铜、生铁 |
| ③ | 基本营养物质 | 蛋白质、维生素、糖类 |
| ④ | 腐蚀品 | 浓硫酸、烧碱、硝酸 |
| ⑤ | 碱性氧化物 | 过氧化钠、氧化镁、氧化铁 |
| ⑥ | 弱电解质 | 醋酸、一水合氨、水 |
| A. | ①②③ | B. | ④⑤⑥ | C. | ②④⑥ | D. | ①⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
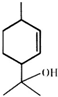
| A. | 松油醇的分子式为C10H16O | |
| B. | 1 mol松油醇与足量金属钠反应可生成标准状况下的H2 22.4L | |
| C. | 可以用酸性高锰酸钾溶液鉴别苯乙烯和松油醇 | |
| D. | 松油醇能发生加成反应、氧化反应、酯化等反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol苯分子中含有双键数 | |
| B. | 1mol CaC2固体中含阴离子总数 | |
| C. | 1L 1mol/L CH3COOH溶液中所含分子总数 | |
| D. | 1mol Cl2参加化学反应获得的电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 推广使用聚二氧化碳可降解塑料,能减少白色污染 | |
| B. | 通常所说的三大有机合成材料是指塑料、合成纤维、合成橡胶 | |
| C. | 实验“煤改气”“煤改电”等清洁燃料改造工程,有利于保护环境 | |
| D. | 夏天雷雨过后感觉到空气清新是因为空气中产生了少量的二氧化氮 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)一定条件下,向一带活塞的密闭容器中充入2mol SO2和1mol O2发生反应:2SO2(g)+O2(g)═2SO3(g),下列说法中,正确的是C.
(1)一定条件下,向一带活塞的密闭容器中充入2mol SO2和1mol O2发生反应:2SO2(g)+O2(g)═2SO3(g),下列说法中,正确的是C.| 相关反应 | 反应热 | 平衡常数K |
| FeS2(s)+H2(g)?FeS(s)+H2S(g) | △H1 | K1 |
| $\frac{1}{2}$FeS2(s)+H2(g)?$\frac{1}{2}$Fe(s)+H2S(g) | △H2 | K2 |
| FeS(s)+H2(g)?Fe(s)+H2S(g) | △H3 | K3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com