���ж��ֺ����ᣬ�����ᣨH
2SO
3�������ᣨH
2SO
4���������ᣨH
2SO
4?SO
3����������ᣨH
2S
2O
3���ȵȣ�����������Ϊ��Ҫ���ڹ�ҵ���й㷺��Ӧ�ã���ʵ���ң�Ũ�����dz��õĸ������
������м��㣺
��1�������ᣨH
2SO
4?SO
3������ˮ�����е�SO
3��ת��Ϊ���ᣬ����445g����������ˮ���4.00L���ᣬ����������ʵ���Ũ��Ϊ
mol/L��
��2������Ũ������ˮ������H
2SO
4?H
2O���㣬250g��������Ϊ98%�����������ն���gˮ��
��3���������ǹ�ҵ�������������Ҫԭ�ϣ��������������յĻ�ѧ��Ӧ���£�
3FeS
2+8O
2��Fe
3O
4+6SO
2 4FeS
2+11O
2��2Fe
2O
3+8SO
2��48mol FeS
2��ȫ��Ӧ��������2934.4L����״���������㷴Ӧ������Fe
3O
4��Fe
2O
3���ʵ���֮�ȣ�
��4����������ȡ���ᣬ���ܳ��������Դ���ܱ�����������һ�ֺ��з�չǰ;���Ʊ�����ķ�����
�����������Ϊ0.84�Ļ�����壨H
2S��H
2O��N
2���ڿ�������ȫȼ�գ�����������77%���������������SO
2���������ˮ�����壩��
��֪������ɣ�N
2�������0.79��O
2�������0.21��



 һ����ʦ�����Ծ�ϵ�д�
һ����ʦ�����Ծ�ϵ�д�
 ��������ȷ���ǣ�������
��������ȷ���ǣ�������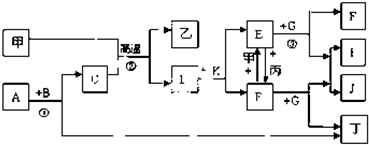
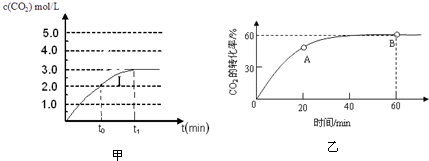
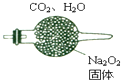 ij��ɫ��Һ��ֻ�������������е�ij���֣�Na+��Mg2+��SO42-��CO32-��Cl-��MnO4-��Ϊ�˼�����Щ���ӣ��ֱ�ȡ������Һ��������ʵ�飺
ij��ɫ��Һ��ֻ�������������е�ij���֣�Na+��Mg2+��SO42-��CO32-��Cl-��MnO4-��Ϊ�˼�����Щ���ӣ��ֱ�ȡ������Һ��������ʵ�飺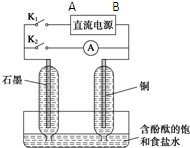 ij��ȤС�������ͼ��ʵ��װ�ã�ʵ��ʱ���ȶϿ�K2���պ�K1�������������ݲ�����һ��ʱ��Ͽ�K1���պ�K2�����ֵ�����Aָ��ƫת��
ij��ȤС�������ͼ��ʵ��װ�ã�ʵ��ʱ���ȶϿ�K2���պ�K1�������������ݲ�����һ��ʱ��Ͽ�K1���պ�K2�����ֵ�����Aָ��ƫת��