
| A、将②、③溶液混合后,pH=7,消耗溶液的体积:②>③ |
| B、①④等体积混合后,溶液显碱性 |
| C、等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量①最大 |
| D、向溶液中加入100mL水后,溶液的pH:③>④>②>① |


科目:高中化学 来源: 题型:
| A、12.2 L |
| B、14.5 L |
| C、15.8 L |
| D、16.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、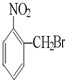 |
B、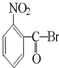 |
C、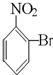 |
D、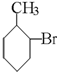 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HA的酸性比HB的强,则等浓度的NaA溶液 pH比NaB溶液的小 |
| B、A+和B-的电子层结构相同,则A原子的核电荷数比B原子的小 |
| C、A盐的溶解度在同温下比B盐的大,则A盐溶液的物质的量浓度比B盐溶液的大 |
| D、A原子失去的电子比B原子的多,则A单质的还原性比B单质的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、醋酸与氢氧化钠溶液反应:CH3COOH+OH-=CH3COO-+H2O |
| B、铁与盐酸反应:2Fe+6H+→2Fe3++3H2↑ |
| C、氯化铁溶液和氨水反应:Fe3++3OH-→Fe(OH)3↓ |
| D、氯化铝溶液中滴入过量氢氧化钠溶液:Al3++3OH-→Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下;22.4LH2O中共价键数目为2NA |
| B、12g金刚石的σ键数目为4 NA |
| C、16gO2与O3的混合气体中氧原子数目为NA |
| D、标准状况下1.12L乙炔中π键数目为0.05 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、E元素处于元素周期表中第3周期第ⅦA族 |
| B、元素A、B、C的原子半径:C>B>A |
| C、元素B、C、D的非金属性:C>B>D |
| D、一定条件下,A单质可以将D单质从其氧化物中置换出来 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com