


分析 锌精矿焙烧得到二氧化硫和ZnO,将ZnO加入NH3-NH4Cl溶液中,发生反应得到[Zn(NH3)4]Cl2,电解[Zn(NH3)4]Cl2溶液得到Zn,
(1)NH3分子中氮原子与氢原子形成三对共用电子对,另外还有一对孤电子对,据此判断空间构型,氨分子之间能形成氢键;
(2)ZnO属于两性氧化物,ZnO与NaOH溶液反应生成Na2ZnO2;
(3)电解过程中析出锌的电极上[Zn(NH3)4]2+ 得电子发生还原反应;
(4)SO2可用Ba(NO3)2溶液吸收,发生氧化还原反应生成一氧化氮和硫酸钡,据此写离子方程式;
(5)由图2可知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-846.3KJ/mol ①
CO2(g)=CO(g)+$\frac{1}{2}$O2(g)△H=+282KJ/mol ②
H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8KJ/mol ③
依据热化学方程式和盖斯定律计算得到所需热化学方程式;
解答 解:(1)NH3分子中氮原子与氢原子形成三对共用电子对,另外还有一对孤电子对,所以NH3的空间构型是三角锥形,因为氨分子之间能形成氢键,所以氨气易液化,
故答案为:三角锥形;氨分子之间能形成氢键;
(2)ZnO属于两性氧化物,ZnO与NaOH溶液反应生成偏锌酸钠和水,反应方程式为2NaOH+ZnO=Na2ZnO2+H2O,
故答案为:2NaOH+ZnO=Na2ZnO2+H2O;
(3)电解过程中析出锌的电极上[Zn(NH3)4]2+ 得电子发生还原反应,电极反应式为[Zn(NH3)4]2++2e-=Zn+4NH3↑,
故答案为:[Zn(NH3)4]2++2e-=Zn+4NH3↑;
(4)SO2可用Ba(NO3)2溶液吸收,发生氧化还原反应生成一氧化氮和硫酸钡,反应的离子方程式为3SO2+2H2O+2NO3-+3Ba2+=3BaSO4↓+2NO↑+4H+,
故答案为:3SO2+2H2O+2NO3-+3Ba2+=3BaSO4↓+2NO↑+4H+;
(5)由图2可知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-846.3KJ/mol ①
CO2(g)=CO(g)+$\frac{1}{2}$O2(g)△H=+282KJ/mol ②
H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8KJ/mol ③
将①+②-③×3可得:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=(-846.3KJ/mol)+(+282KJ/mol )-(-241.8KJ/mol )×3=+161.1 kJ•mol-1,所以CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+161.1 kJ•mol-1,
故答案为:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+161.1 kJ•mol-1;
点评 本题考查了热化学方程式书写方法、化学方程式和电极方程式的书写,掌握基础是关键,题目难度中等.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | NaOH[Ba(OH)2]:使用Na2SO4溶液 | B. | KOH(K2SO4):使用Ba(OH)2溶液 | ||
| C. | NaCl(Na2SO4):使用Ba(NO3)2溶液 | D. | HNO3(HCl):使用AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
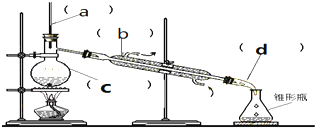
| A. | 仪器C是圆底烧瓶,加热时,液体量不超过容积的$\frac{2}{3}$,不少于容积的$\frac{1}{3}$ | |
| B. | 仪器b是直型冷凝管 | |
| C. | 仪器b中冷却水的进出方向是“下进上出” | |
| D. | 进行蒸馏操作时,温度计的下端不能放在液面以下 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
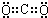
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+═4Fe3++2H2O | |
| B. | 向碳酸氢钙溶液中加入过量氢氧化钠 Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| C. | 用铁棒作阴极、炭棒作阳极电解饱和氯化钠溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- | |
| D. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:2Ba2++Al3++2SO42-+4OH-═AlO2-+2BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加SO2的浓度,正反应速率先增大,后逐渐减小最后保持不变 | |
| B. | 增加O2的浓度,正反应速率逐渐增大 | |
| C. | 增加SO2的浓度,平衡常数增大 | |
| D. | 若平衡时SO2的浓度比原来大,则平衡常数增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com