
| A. | 明矾可用于净水 | |
| B. | 氨可用于生产铵盐、纯碱 | |
| C. | 铝热反应可用于冶炼某些金属 | |
| D. | 核磁共振氢谱可用于测量某些有机物的相对分子质量 |
分析 A、明矾能水解出氢氧化铝胶体;
B、侯氏制碱法的原料是氯化钠、氨气和二氧化碳;
C、铝热反应是金属铝和某些金属氧化物反应生成氧化铝和金属单质的反应;
D、核磁共振可以测定有机物中的氢原子的种类.
解答 解:A、明矾能水解出氢氧化铝胶体,具有吸附性,故可以净水,故A正确;
B、侯氏制碱法的原料是氯化钠、氨气和二氧化碳,氨气和酸反应能制得铵盐,故氨既能生产铵盐也能生产纯碱,故B正确;
C、铝热反应是金属铝和某些金属氧化物反应生成氧化铝和金属单质的反应,故可以用于冶炼某些金属,故C正确;
D、核磁共振可以测定有机物中的氢原子的种类,而测定有机物的相对分子质量用质谱法,故D错误.
故选D.
点评 本题考查了常见化学物质的用途和有机物结构的测定等问题,应注意的是纯碱只能净水不能消毒.


科目:高中化学 来源: 题型:解答题
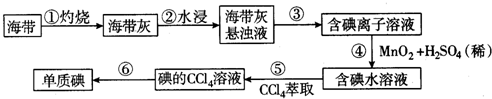
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
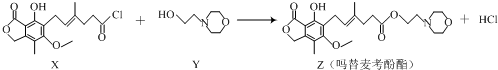
| A. | 化合物X中含有手性碳原子 | B. | 化合物Y的分子式为C6H12NO2 | ||
| C. | 1mol化合物Z可以与3mol NaOH反应 | D. | 用溴水可鉴别化合物X和Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 麦芽糖及其水解产物均能发生银镜反应 | |
| B. | 饱和硫酸铵和醋酸铅溶液均能使鸡蛋清溶液发生变性 | |
| C. | 油脂、二肽发生水解反应均可能得到含羧基的物质 | |
| D. | 天然橡胶 和杜仲胶 和杜仲胶 的单体是同种物质 的单体是同种物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫与氢氧化钠溶液反应 | B. | 钠与氧气的反应 | ||
| C. | 铁在硫蒸气中燃烧 | D. | 铁粉加入硝酸中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | 甲 | 乙 | 丙 | |
| 起始量 | n(SO2)/mol | 0.4 | 0.8 | 0.8 |
| n(O2)/mol | 0.24 | 0.24 | 0.48 | |
| SO2的平衡转化率 | 80% | α1 | α2 | |
| A. | 0~5min内,甲中SO2的反应速率为0.032mol•L-1•min-1 | |
| B. | T℃时,该反应的平衡常数K=400 | |
| C. | 平衡时,SO2的转化率:α1<80%<α2 | |
| D. | 平衡时,丙中气体平均相对分子质量与甲相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
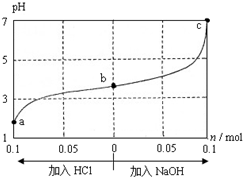 25℃时,将1.0L w mol•L-1 CH3COOH溶液与0.1mol NaOH固体混合,充分反应后向混合液中通(加)入HCl气体或NaOH固体,溶液pH随加入HCl或NaOH的物质的量而变化如图.下列叙述正确的是( )
25℃时,将1.0L w mol•L-1 CH3COOH溶液与0.1mol NaOH固体混合,充分反应后向混合液中通(加)入HCl气体或NaOH固体,溶液pH随加入HCl或NaOH的物质的量而变化如图.下列叙述正确的是( )| A. | a、b、c 对应的混合液中,水的电离程度由大到小的顺序的是a>b>c | |
| B. | c点混合液中c(Na+)>c(CH3COO-) | |
| C. | a、b、c三点都有c(CH3COO-)+c(OH-)=c(Na+)+c(H+) | |
| D. | 若忽略体积变化,则25℃时CH3COOH的电离平衡常数 K=$\frac{0.2}{w-0.2}$×10-7 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高一上10月月考化学试卷(解析版) 题型:选择题
下列实验操作能达到实验目的的是
选项 | 实验目的 | 实验操作 |
A | 除去CO中少量的CO2 | 通过足量灼热CuO |
B | 除去CuCO3溶液中的少量 CuO | 加入足量稀H2SO4后,过滤 |
C | 鉴别澄清石灰水和NaOH溶液 | 加入稀HCl |
D | 鉴别硬水和软水 | 加入肥皂水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com