
Ę½ŗāÖøµÄŹĒĮ½øöĻą·“·½ĻņµÄ±ä»Æ×īŗóĖł“¦µÄŌĖ¶ÆדĢ¬;֊ѧ½×¶ĪÉę¼°µÄĘ½ŗāÓŠĘų
ĢåæÉÄę·“Ó¦µÄĘ½ŗā”¢Ėį¼īµēĄėĘ½ŗā”¢Ė®½āĘ½ŗā¼°³Įµķ”ŖČܽāĘ½ŗāµČµČ”£
(1)ĻÖÓŠČŻ»żĪŖ2LµÄŗćĪĀŗćČŻĆܱÕČŻĘ÷£¬ĻņĘäÖŠ¼ÓČė2molAĘųĢåŗĶ2molBĘųĢåŗó·¢
ÉśČēĻĀ·“Ó¦£ŗ A(g)Ź®B(g)![]() C(g)
C(g) ![]()
20sŗ󣬷“Ó¦“ļµ½Ę½ŗāדĢ¬£¬Éś³ÉlmolCĘųĢ壬·Å³öČČĮæQ1kJ”£»Ų“šĻĀĮŠĪŹĢā”£
¢Ł¼ĘĖć 20sÄŚBĘųĢåµÄĘ½¾ł»Æѧ·“Ó¦ĖŁĀŹĪŖ £¬Ēó³öøĆ·“Ó¦µÄĘ½ŗā³£Źż
ӣ
¢Ś±£³ÖČŻĘ÷ĪĀ¶ČŗĶČŻ»ż²»±ä£¬ČōøÄĪŖĻņĘäÖŠ¼ÓČė1molCĘųĢ壬·“Ó¦“ļµ½Ę½ŗāŹ±£¬ĪüŹÕČČĮæQkJ£¬ŌņQ1ÓėQ2µÄĻą»„¹ŲĻµÕżČ·µÄŹĒ £ØĢī×ÖÄø£©”£
(A)Ql+Q2=a (B)Q1+2Q2<2a (C) Q1+2Q2>2a (D) Ql+Q2<a
(2)¼×“¼ŹĒŅ»ÖÖæÉŌŁÉśÄÜŌ“£¬¾ßÓŠæŖ·¢ŗĶÓ¦ÓĆµÄ¹ćĄ«Ē°¾°£¬¹¤ŅµÉĻæÉÓĆŗĻ³ÉĘųÖʱø¼×“¼”£·“Ó¦ĪŖCO(g)+2H2(g)![]() CH3OH(g)ijĪĀ¶ČĻĀ£¬ŌŚČŻ»żĪŖ2LµÄĆܱÕČŻĘ÷ÖŠ½ųŠŠøĆ·“Ó¦£¬ĘäĻą¹Ų ĘäĻą¹ŲŹż¾Ż¼ūĻĀĶ¼£ŗ
CH3OH(g)ijĪĀ¶ČĻĀ£¬ŌŚČŻ»żĪŖ2LµÄĆܱÕČŻĘ÷ÖŠ½ųŠŠøĆ·“Ó¦£¬ĘäĻą¹Ų ĘäĻą¹ŲŹż¾Ż¼ūĻĀĶ¼£ŗ

¢ŁtminÖĮ2tminŹ±ĖŁĀŹ±ä»ÆµÄŌŅņæÉÄÜŹĒ £»
¢Ś3tminŹ±¶Ō·“Ó¦ĢåĻµ²ÉČ”ĮĖŅ»øö“ėŹ©£¬ÖĮ4tminŹ±COµÄĪļÖŹµÄĮæĪŖ0.5mol£¬ĒėĶź³ÉÉĻĶ¼COµÄ±ä»ÆĒśĻß”£
(3)³£ĪĀĻĀ£¬½«VmL”¢0.1000mol”¤L-1ĒāŃõ»ÆÄĘČÜŅŗÖšµĪ¼ÓČėµ½20.00mol”¤L-1“×Ėį
ČÜŅŗÖŠ£¬³ä·Ö·“Ó¦”£»Ų“šĻĀĮŠĪŹĢā”£(ŗöĀŌČÜŅŗĢå»żµÄ±ä»Æ)
¢ŁČē¹ūČÜŅŗpH=7£¬“ĖŹ±VµÄȔֵ 20.00(Ģī”°>”±”¢”°<”±»ņ”°=")£¬¶ųČÜŅŗÖŠ”£c(Na+)”¢
ŅŌ![]() µÄ“󊔹ŲĻµ;
µÄ“󊔹ŲĻµ;
ӣ
¢ŚČē ¹ū V=40.00£¬Ōņ “Ė Ź± ČÜŅŗ ÖŠ ![]()
mol”¤L-1
(4)ijĪĀ¶ČĢõ¼žĻĀ£¬Čō½«CO2(g)ŗĶH2(g)ŅŌĢå»ż±Č1:4»ģŗĻ£¬ŌŚŹŹµ±Ń¹ĒæŗĶ“߻ƼĮ
×÷ÓĆĻĀæÉÖĘµĆ¼×Ķ飬¼ŗÖŖ:
![]()
ŌņCO2(g)ŗĶH2(g)·“Ӧɜ³ÉŅŗĢ¬Ė®µÄČČ»Æѧ·½³ĢŹ½ĪŖ:

| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŌĶĮĄķ½ā
| c(C) |
| c(A)?c(B) |
| c(C) |
| c(A)?c(B) |
| 1 |
| 3 |
| 1 |
| 30 |
| 1 |
| 30 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2013½ģ½ĖÕŹ”Ģ©ÖŻÖŠŃ§øßČżÉĻŃ§ĘŚĘŚÖŠæ¼ŹŌ»ÆѧŹŌ¾ķ£Ø“ų½āĪö£© ĢāŠĶ£ŗĢīæÕĢā
£Ø15·Ö£©Ę½ŗāÖøµÄŹĒĮ½øöĻą·“·½ĻņµÄ±ä»Æ×īŗóĖł“¦µÄŌĖ¶ÆדĢ¬£»ŌŚĘ½ŗāŹ±£¬Į½ÖÖ±ä»ÆČŌŌŚ¼ĢŠų½ųŠŠ£¬µ«ŹĒĖüĆĒµÄĖŁĀŹĻąµČ£»øł¾Ż±ä»ÆµÄŠŌÖŹæÉ·ÖĪŖĪļĄķĘ½ŗāŗĶ»ÆŃ§Ę½ŗā£¬ÖŠŃ§½×¶ĪÉę¼°µÄĘ½ŗāÓŠĘųĢåæÉÄę·“Ó¦µÄĘ½ŗā”¢Ėį¼īµēĄėĘ½ŗā”¢Ė®½āĘ½ŗā¼°³Įµķ£ČܽāĘ½ŗāµČµČ”£
£Ø1£©ĻÖÓŠČŻ»żĪŖ1 LµÄŗćĪĀŗćČŻĆܱÕČŻĘ÷£¬ĻņĘäÖŠ¼ÓČė2 mol AĘųĢåŗĶ2 mol BĘųĢåŗó·¢ÉśČēĻĀ·“Ó¦£ŗA(g)£«B(g) C(g) ”÷H=" -" a kJ”¤mol-1£¬20sŗ󣬷“Ó¦“ļµ½Ę½ŗāדĢ¬£¬Éś³É1 mol CĘųĢ壬·Å³öČČĮæQ1kJ”£»Ų“šĻĀĮŠĪŹĢā”£
C(g) ”÷H=" -" a kJ”¤mol-1£¬20sŗ󣬷“Ó¦“ļµ½Ę½ŗāדĢ¬£¬Éś³É1 mol CĘųĢ壬·Å³öČČĮæQ1kJ”£»Ų“šĻĀĮŠĪŹĢā”£
¢Ł¼ĘĖć20sÄŚBĘųĢåµÄĘ½¾ł»Æѧ·“Ó¦ĖŁĀŹĪŖ___________£¬Š“³öøĆ·“Ó¦µÄĘ½ŗā³£Źż±ķ“ļŹ½___________”£
¢Ś±£³ÖČŻĘ÷ĪĀ¶ČŗĶČŻ»ż²»±ä£¬ČōøÄĪŖĻņĘäÖŠ¼ÓČė1molCĘųĢ壬·“Ó¦“ļµ½Ę½ŗāŹ±£¬ĪüŹÕČČĮæQ2kJ£¬ŌņQ1 ÓėQ2µÄĻą»„¹ŲĻµÕżČ·µÄŹĒ____________£ØĢī×ÖÄø£©”£
£ØA£©Q1 + Q2 = a £ØB£© Q1 + 2Q2 < 2a £ØC£©Q1 + 2Q2 > 2a £ØD£©Q1 + Q2 < a
¢ŪŌŚŌĘ½ŗā»ł“”ÉĻ£¬±£³ÖČŻĘ÷ĪĀ¶ČŗĶČŻ»ż²»±ä£¬ĻņČŻĘ÷ÖŠŌŁĶØČėbmolAĘųĢå£Øb>0£©Ź±£¬v(Õż)_____v(Äę)£ØĢī”°>”±”¢”°<”±»ņ”°=”±£©£¬ÖŲŠĀ“ļĘ½ŗāŗó£¬CĘųĢåµÄĘ½ŗāĢå»ż·ÖŹż (C) =
(C) = 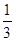 £¬Ōņb = ____________”£
£¬Ōņb = ____________”£
£Ø2£©³£ĪĀĻĀ£¬½«VmL”¢0.1000mol”¤L-1ĒāŃõ»ÆÄĘČÜŅŗÖšµĪ¼ÓČėµ½20.00mL”¢0.1000mol”¤L-1“×ĖįČÜŅŗÖŠ£¬³ä·Ö·“Ó¦”£»Ų“šĻĀĮŠĪŹĢā”££ØŗöĀŌČÜŅŗĢå»żµÄ±ä»Æ£©
¢ŁČē¹ūČÜŅŗpH=7£¬“ĖŹ±VµÄȔֵ_____20.00£ØĢī”°>”±”¢”°<”±»ņ”°=”±£©£¬¶ųČÜŅŗÖŠc(Na+)”¢c(CH3COO-)”¢c(H+)”¢c(OH-)µÄ“󊔹ŲĻµĪŖ_____________________________________________”£
¢ŚČē¹ūV=40.00£¬Ōņ“ĖŹ±ČÜŅŗÖŠc(OH£) -c(H£«) - c(CH3COOH)= ___________________mol”¤L-1”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2013½ģɽ¶«Ź”¼ĆÄžŹŠÓćĢØŅ»ÖŠøßČżÉĻŃ§ĘŚĘŚÖŠæ¼ŹŌ»ÆѧŹŌ¾ķ£Ø“ų½āĪö£© ĢāŠĶ£ŗĢīæÕĢā
£Ø16·Ö£©Ę½ŗāÖøµÄŹĒĮ½øöĻą·“·½ĻņµÄ±ä»Æ×īŗóĖł“¦µÄŌĖ¶ÆדĢ¬£»ŌŚĘ½ŗāŹ±£¬Į½ÖÖ±ä»ÆČŌŌŚ¼ĢŠų½ųŠŠ£¬µ«ŹĒĖüĆĒµÄĖŁĀŹĻąµČ£»øł¾Ż±ä»ÆµÄŠŌÖŹæÉ·ÖĪŖĪļĄķĘ½ŗāŗĶ»ÆŃ§Ę½ŗā£¬ÖŠŃ§½×¶ĪÉę¼°µÄĘ½ŗāÓŠĘųĢåæÉÄę·“Ó¦µÄĘ½ŗā”¢Ėį¼īµēĄėĘ½ŗā”¢Ė®½āĘ½ŗā¼°³Įµķ£ČܽāĘ½ŗāµČµČ”£
£Ø1£©ĻÖÓŠČŻ»żĪŖ1 LµÄŗćĪĀŗćČŻĆܱÕČŻĘ÷£¬ĻņĘäÖŠ¼ÓČė2 mol AĘųĢåŗĶ2 mol BĘųĢåŗó·¢ÉśČēĻĀ·“Ó¦£ŗ
A(g) £« B(g)  C(g) ”÷H= - a kJ”¤mol-1
C(g) ”÷H= - a kJ”¤mol-1
20sŗ󣬷“Ó¦“ļµ½Ę½ŗāדĢ¬£¬Éś³É1 mol CĘųĢ壬·Å³öČČĮæQ1kJ”£»Ų“šĻĀĮŠĪŹĢā”£
¢Ł¼ĘĖć20sÄŚBĘųĢåµÄĘ½¾ł»Æѧ·“Ó¦ĖŁĀŹĪŖ___________£¬Š“³öøĆ·“Ó¦µÄĘ½ŗā³£Źż±ķ“ļŹ½___________”£
¢Ś±£³ÖČŻĘ÷ĪĀ¶ČŗĶČŻ»ż²»±ä£¬ČōøÄĪŖĻņĘäÖŠ¼ÓČė1molCĘųĢ壬·“Ó¦“ļµ½Ę½ŗāŹ±£¬ĪüŹÕČČĮæQ2kJ£¬ŌņQ1 ÓėQ2µÄĻą»„¹ŲĻµÕżČ·µÄŹĒ____________£ØĢī×ÖÄø£©”£
£ØA£©Q1 + Q2 = a £ØB£© Q1 + 2Q2 < 2a £ØC£©Q1 + 2Q2 > 2a £ØD£©Q1 + Q2 < a
¢ŪŌŚŌĘ½ŗā»ł“”ÉĻ£¬±£³ÖČŻĘ÷ĪĀ¶ČŗĶČŻ»ż²»±ä£¬ĻņČŻĘ÷ÖŠŌŁĶØČėb mol AĘųĢå£Øb>0£©Ź±£¬v(Õż)_____v(Äę)£ØĢī”°>”±”¢”°<”±»ņ”°=”±£©£¬ÖŲŠĀ“ļĘ½ŗāŗó£¬CĘųĢåµÄĘ½ŗāĢå»ż·ÖŹż (C) =
(C) = 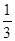 £¬Ōņb = ____________”£
£¬Ōņb = ____________”£
£Ø2£©³£ĪĀĻĀ£¬½«VmL”¢0.1000mol”¤L-1ĒāŃõ»ÆÄĘČÜŅŗÖšµĪ¼ÓČėµ½20.00mL”¢0.1000mol”¤L-1“×ĖįČÜŅŗÖŠ£¬³ä·Ö·“Ó¦”£»Ų“šĻĀĮŠĪŹĢā”££ØŗöĀŌČÜŅŗĢå»żµÄ±ä»Æ£©
¢ŁČē¹ūČÜŅŗpH=7£¬“ĖŹ±VµÄȔֵ_____20.00£ØĢī”°>”±”¢”°<”±»ņ”°=”±£©£¬¶ųČÜŅŗÖŠc(Na£«)”¢c(CH3COO£)”¢c(H£«)”¢c(OH£)µÄ“󊔹ŲĻµĪŖ_____________________________________________”£
¢ŚČē¹ūV=40.00£¬Ōņ“ĖŹ±ČÜŅŗÖŠc(OH£) - c(H£«) - c(CH3COOH)= ___________________mol”¤L-1”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2012-2013ѧğ½ĖÕŹ”øßČżÉĻŃ§ĘŚĘŚÖŠæ¼ŹŌ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
£Ø15·Ö£©Ę½ŗāÖøµÄŹĒĮ½øöĻą·“·½ĻņµÄ±ä»Æ×īŗóĖł“¦µÄŌĖ¶ÆדĢ¬£»ŌŚĘ½ŗāŹ±£¬Į½ÖÖ±ä»ÆČŌŌŚ¼ĢŠų½ųŠŠ£¬µ«ŹĒĖüĆĒµÄĖŁĀŹĻąµČ£»øł¾Ż±ä»ÆµÄŠŌÖŹæÉ·ÖĪŖĪļĄķĘ½ŗāŗĶ»ÆŃ§Ę½ŗā£¬ÖŠŃ§½×¶ĪÉę¼°µÄĘ½ŗāÓŠĘųĢåæÉÄę·“Ó¦µÄĘ½ŗā”¢Ėį¼īµēĄėĘ½ŗā”¢Ė®½āĘ½ŗā¼°³Įµķ£ČܽāĘ½ŗāµČµČ”£
£Ø1£©ĻÖÓŠČŻ»żĪŖ1 LµÄŗćĪĀŗćČŻĆܱÕČŻĘ÷£¬ĻņĘäÖŠ¼ÓČė2 mol AĘųĢåŗĶ2 mol BĘųĢåŗó·¢ÉśČēĻĀ·“Ó¦£ŗA(g)£«B(g) C(g) ”÷H= - a kJ”¤mol-1£¬20sŗ󣬷“Ó¦“ļµ½Ę½ŗāדĢ¬£¬Éś³É1 mol CĘųĢ壬·Å³öČČĮæQ1kJ”£»Ų“šĻĀĮŠĪŹĢā”£
C(g) ”÷H= - a kJ”¤mol-1£¬20sŗ󣬷“Ó¦“ļµ½Ę½ŗāדĢ¬£¬Éś³É1 mol CĘųĢ壬·Å³öČČĮæQ1kJ”£»Ų“šĻĀĮŠĪŹĢā”£
¢Ł¼ĘĖć20sÄŚBĘųĢåµÄĘ½¾ł»Æѧ·“Ó¦ĖŁĀŹĪŖ___________£¬Š“³öøĆ·“Ó¦µÄĘ½ŗā³£Źż±ķ“ļŹ½___________”£
¢Ś±£³ÖČŻĘ÷ĪĀ¶ČŗĶČŻ»ż²»±ä£¬ČōøÄĪŖĻņĘäÖŠ¼ÓČė1molCĘųĢ壬·“Ó¦“ļµ½Ę½ŗāŹ±£¬ĪüŹÕČČĮæQ2kJ£¬ŌņQ1 ÓėQ2µÄĻą»„¹ŲĻµÕżČ·µÄŹĒ____________£ØĢī×ÖÄø£©”£
£ØA£©Q1 + Q2 = a £ØB£© Q1 + 2Q2 < 2a £ØC£©Q1 + 2Q2 > 2a £ØD£©Q1 + Q2 < a
¢ŪŌŚŌĘ½ŗā»ł“”ÉĻ£¬±£³ÖČŻĘ÷ĪĀ¶ČŗĶČŻ»ż²»±ä£¬ĻņČŻĘ÷ÖŠŌŁĶØČėbmolAĘųĢå£Øb>0£©Ź±£¬v(Õż)_____v(Äę)£ØĢī”°>”±”¢”°<”±»ņ”°=”±£©£¬ÖŲŠĀ“ļĘ½ŗāŗó£¬CĘųĢåµÄĘ½ŗāĢå»ż·ÖŹż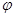 (C) =
(C) = 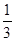 £¬Ōņb = ____________”£
£¬Ōņb = ____________”£
£Ø2£©³£ĪĀĻĀ£¬½«VmL”¢0.1000mol”¤L-1ĒāŃõ»ÆÄĘČÜŅŗÖšµĪ¼ÓČėµ½20.00mL”¢0.1000mol”¤L-1“×ĖįČÜŅŗÖŠ£¬³ä·Ö·“Ó¦”£»Ų“šĻĀĮŠĪŹĢā”££ØŗöĀŌČÜŅŗĢå»żµÄ±ä»Æ£©
¢ŁČē¹ūČÜŅŗpH=7£¬“ĖŹ±VµÄȔֵ_____20.00£ØĢī”°>”±”¢”°<”±»ņ”°=”±£©£¬¶ųČÜŅŗÖŠc(Na+)”¢c(CH3COO-)”¢ c(H+)”¢c(OH-)µÄ“󊔹ŲĻµĪŖ_____________________________________________”£
¢ŚČē¹ūV=40.00£¬Ōņ“ĖŹ±ČÜŅŗÖŠc(OH£) -c(H£«) - c(CH3COOH)= ___________________mol”¤L-1”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2012-2013Ń§ÄźÉ½¶«Ź”¼ĆÄžŹŠøßČżÉĻŃ§ĘŚĘŚÖŠæ¼ŹŌ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
£Ø16·Ö£©Ę½ŗāÖøµÄŹĒĮ½øöĻą·“·½ĻņµÄ±ä»Æ×īŗóĖł“¦µÄŌĖ¶ÆדĢ¬£»ŌŚĘ½ŗāŹ±£¬Į½ÖÖ±ä»ÆČŌŌŚ¼ĢŠų½ųŠŠ£¬µ«ŹĒĖüĆĒµÄĖŁĀŹĻąµČ£»øł¾Ż±ä»ÆµÄŠŌÖŹæÉ·ÖĪŖĪļĄķĘ½ŗāŗĶ»ÆŃ§Ę½ŗā£¬ÖŠŃ§½×¶ĪÉę¼°µÄĘ½ŗāÓŠĘųĢåæÉÄę·“Ó¦µÄĘ½ŗā”¢Ėį¼īµēĄėĘ½ŗā”¢Ė®½āĘ½ŗā¼°³Įµķ£ČܽāĘ½ŗāµČµČ”£
£Ø1£©ĻÖÓŠČŻ»żĪŖ1 LµÄŗćĪĀŗćČŻĆܱÕČŻĘ÷£¬ĻņĘäÖŠ¼ÓČė2 mol AĘųĢåŗĶ2 mol BĘųĢåŗó·¢ÉśČēĻĀ·“Ó¦£ŗ
A(g) £« B(g)  C(g) ”÷H=
- a kJ”¤mol-1
C(g) ”÷H=
- a kJ”¤mol-1
20sŗ󣬷“Ó¦“ļµ½Ę½ŗāדĢ¬£¬Éś³É1 mol CĘųĢ壬·Å³öČČĮæQ1kJ”£»Ų“šĻĀĮŠĪŹĢā”£
¢Ł¼ĘĖć20sÄŚBĘųĢåµÄĘ½¾ł»Æѧ·“Ó¦ĖŁĀŹĪŖ___________£¬Š“³öøĆ·“Ó¦µÄĘ½ŗā³£Źż±ķ“ļŹ½___________”£
¢Ś±£³ÖČŻĘ÷ĪĀ¶ČŗĶČŻ»ż²»±ä£¬ČōøÄĪŖĻņĘäÖŠ¼ÓČė1molCĘųĢ壬·“Ó¦“ļµ½Ę½ŗāŹ±£¬ĪüŹÕČČĮæQ2kJ£¬ŌņQ1 ÓėQ2µÄĻą»„¹ŲĻµÕżČ·µÄŹĒ____________£ØĢī×ÖÄø£©”£
£ØA£©Q1 + Q2 = a £ØB£© Q1 + 2Q2 < 2a £ØC£©Q1 + 2Q2 > 2a £ØD£©Q1 + Q2 < a
¢ŪŌŚŌĘ½ŗā»ł“”ÉĻ£¬±£³ÖČŻĘ÷ĪĀ¶ČŗĶČŻ»ż²»±ä£¬ĻņČŻĘ÷ÖŠŌŁĶØČėb mol AĘųĢå£Øb>0£©Ź±£¬v(Õż)_____v(Äę)£ØĢī”°>”±”¢”°<”±»ņ”°=”±£©£¬ÖŲŠĀ“ļĘ½ŗāŗó£¬CĘųĢåµÄĘ½ŗāĢå»ż·ÖŹż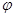 (C)
=
(C)
= 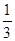 £¬Ōņb
= ____________ӣ
£¬Ōņb
= ____________ӣ
£Ø2£©³£ĪĀĻĀ£¬½«VmL”¢0.1000mol”¤L-1ĒāŃõ»ÆÄĘČÜŅŗÖšµĪ¼ÓČėµ½20.00mL”¢0.1000mol”¤L-1“×ĖįČÜŅŗÖŠ£¬³ä·Ö·“Ó¦”£»Ų“šĻĀĮŠĪŹĢā”££ØŗöĀŌČÜŅŗĢå»żµÄ±ä»Æ£©
¢ŁČē¹ūČÜŅŗpH=7£¬“ĖŹ±VµÄȔֵ_____20.00£ØĢī”°>”±”¢”°<”±»ņ”°=”±£©£¬¶ųČÜŅŗÖŠc(Na£«)”¢c(CH3COO£)”¢ c(H£«)”¢c(OH£)µÄ“󊔹ŲĻµĪŖ_____________________________________________”£
¢ŚČē¹ūV=40.00£¬Ōņ“ĖŹ±ČÜŅŗÖŠc(OH£) - c(H£«) - c(CH3COOH)= ___________________mol”¤L-1”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com