
| A. | 晶体硅是良好的半导体材料 | |
| B. | 光导纤维中成分和沙子中的主要成分相同 | |
| C. | 用通入澄清石灰水的方法可以区分出CO2和SO2气体 | |
| D. | SO2的漂白原理与木炭、过氧化钠及湿润氯气的漂白原理不同 |
分析 A.晶体硅导电性介于导体与绝缘体之间;
B.二氧化硅是光导纤维和沙子的主要成分;
C.二氧化硫与二氧化碳均能够使石灰水变浑浊;
D.依据二氧化硫、活性炭、过氧化钠、次氯酸漂白原理解答.
解答 解:A.晶体硅导电性介于导体与绝缘体之间,是良好的半导体材料,故A正确;
B.光导纤维中成分和沙子中的主要成分相同,都是二氧化硅,故B正确;
C.二氧化硫与二氧化碳均能够使石灰水变浑浊,二者与石灰水反应现象相同,不能区别,故C错误;
D.二氧化硫与有色物质化合生成无色物质而具有漂白性,活性炭具有吸附性而具有漂白性,次氯酸、过氧化钠因具有强的氧化性而具有漂白性,所以他们漂白原理不同,故D正确;
故选:C.
点评 本题考查了元素化合物知识,熟悉硅、二氧化硅、二氧化硫的性质是解题关键,注意明确常见漂白剂漂白原理,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1 molAl3+离子含有的核外电子数为3NA | |
| B. | 1.7gH2O2中含有的电子数为0.9NA | |
| C. | 常温下,11.2L的甲烷气体含有甲烷分子数为0.5NA个 | |
| D. | 标准状况下,33.6LH2O含有9.03×1023个H2O分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
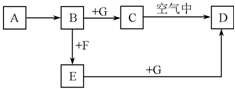 A~G是中学化学中常见的物质,在一定条件下它们之间的转化关系如图所示,其中A为金属,F是一种有毒的气体单质,G为NaOH溶液.
A~G是中学化学中常见的物质,在一定条件下它们之间的转化关系如图所示,其中A为金属,F是一种有毒的气体单质,G为NaOH溶液.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 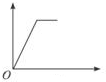 | B. | 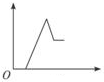 | C. | 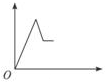 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
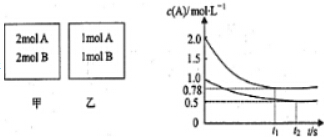
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol•L-1的NaHSO3溶液与1.0mol•L-1的NaClO溶液等体积混合:HSO3-+ClO-═SO42-+Cl-+H+ | |
| B. | 向Ca(HCO3)2溶液中加入足量的澄清石灰水:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| C. | 氢氧化铁溶于氢碘酸中:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O | |
| D. | H218O中投入Na2O2固体:2H218O+2Na2O2═4OH-+4Na++18O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
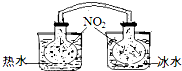 (1)已知:2NO2 ?N2O4(g)△H<0.如图所示,放入热水中的NO2球产生的现象为红棕色变深
(1)已知:2NO2 ?N2O4(g)△H<0.如图所示,放入热水中的NO2球产生的现象为红棕色变深查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Cl-、NO3-、Na+ | B. | CO32-、NH4+、Cl-、Ca2+ | ||
| C. | 中性溶液中:Fe3+、Cl-、NO3-、Na+ | D. | Fe3+、Cl-、NO3-、Na+、SCN- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com