
(1)写热化学方程式:
在101kPa时,H
2在1.00molO
2中完全燃烧生成2.00mol液态H
2O,放出571.6kJ的热量,表示H
2燃烧热的热化学方程式
H
2(g)+
O
2(g)=H
2O(l)△H=-285.8KJ/mol
H
2(g)+
O
2(g)=H
2O(l)△H=-285.8KJ/mol
;
1.00L 1.00mol/L H
2SO
4溶液与2.00L 1.00mol/L NaOH溶液完全反应,放出114.6kJ的热量,该反应的反应热为
-11.46kJ/mol
-11.46kJ/mol
,表示其中和热的热化学方程式为
NaOH(aq)+
H
2SO
4(aq)=
Na
2SO
4(aq)+H
2O(l)△H=-57.3kJ/mol
NaOH(aq)+
H
2SO
4(aq)=
Na
2SO
4(aq)+H
2O(l)△H=-57.3kJ/mol
.
(2)恒温条件下,将2.0molSO
2与amolO
2混合通入一个2L密闭容器中,发生如下反应:2SO
2(g)+O
2(g)2SO
3(g).反应20s后达平衡时,测得容器内n(SO
3)=1.3mol,n(O
2)=3.0mol.则a的值为:
3.65
3.65
;平衡时SO
2的转化率为:
65%
65%
.用SO
3表示该化学反应速率为:
0.0325mol/(L?min)
0.0325mol/(L?min)
.
(3)根据如图所示原电池装置回答下列问题
负极材料:
锌
锌
,电极反应式:
Zn-2e-═Zn2+
Zn-2e-═Zn2+
,电子由
负
负
电极经外电路流向
正
正
电极.

 (1)写热化学方程式:
(1)写热化学方程式: 2SO3(g).
2SO3(g).

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
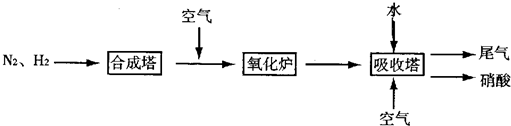
期末集结号系列答案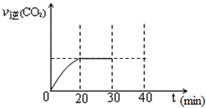 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.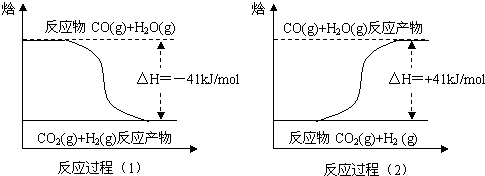

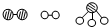 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别为
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别为