
 (1,3-环己二烯)的各步反应方程式
(1,3-环己二烯)的各步反应方程式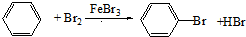
 +3H2$\stackrel{一定条件下}{→}$
+3H2$\stackrel{一定条件下}{→}$
 +NaOH$→_{△}^{乙醇}$
+NaOH$→_{△}^{乙醇}$ +H2O+NaBr
+H2O+NaBr +Br2→
+Br2→
 +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$ +2NaBr+2H2O.
+2NaBr+2H2O. 分析 在FeBr3作催化剂条件下,苯和液溴发生取代反应生成溴苯,溴苯和氢气在一定条件下发生加成反应生成1-溴环己烷,1-溴环己烷和NaOH的醇溶液加热生成环己烯,环己烯和溴发生加成反应生成1,2-二溴环己烷,1,2-二溴环己烷和NaOH的醇溶液加热发生消去反应生成 ,据此分析解答.
,据此分析解答.
解答 解:在FeBr3作催化剂条件下,苯和液溴发生取代反应生成溴苯,溴苯和氢气在一定条件下发生加成反应生成1-溴环己烷,1-溴环己烷和NaOH的醇溶液加热生成环己烯,环己烯和溴发生加成反应生成1,2-二溴环己烷,1,2-二溴环己烷和NaOH的醇溶液加热发生消去反应生成 ,涉及的反应方程式分别为:
,涉及的反应方程式分别为: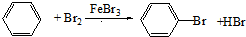 、
、 +3H2$\stackrel{一定条件下}{→}$
+3H2$\stackrel{一定条件下}{→}$ 、
、 +NaOH$→_{△}^{乙醇}$
+NaOH$→_{△}^{乙醇}$ +H2O+NaBr、
+H2O+NaBr、 +Br2→
+Br2→ 、
、 +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$ +2NaBr+2H2O,
+2NaBr+2H2O,
故答案为: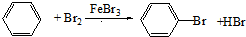 ;
; +3H2$\stackrel{一定条件下}{→}$
+3H2$\stackrel{一定条件下}{→}$ ;
; +NaOH$→_{△}^{乙醇}$
+NaOH$→_{△}^{乙醇}$ +H2O+NaBr;
+H2O+NaBr; +Br2→
+Br2→ ;
; +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$ +2NaBr+2H2O.
+2NaBr+2H2O.
点评 本题以有机合成为载体考查化学方程式的书写,明确官能团及其性质关系是解本题关键,注意物质发生反应时的反应条件,反应物相同其条件不同会导致产物不同,注意溴代烷发生消去反应、水解反应条件的区别,题目难度不大.


科目:高中化学 来源: 题型:选择题
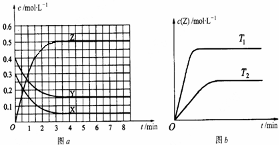
| A. | 该反应的正反应是放热反应 | |
| B. | T0时,该反应的平衡常数为$\frac{1}{3}$ | |
| C. | 反应时各物质的反应速率关系为:2v (X)=2v (Y)=v (Z) | |
| D. | 图a中反应达到平衡时,Y的转化率为37.5% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 溴水 | B. | 酸性高锰酸钾溶液 | ||
| C. | 溴的CCl4溶液 | D. | 银氨溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
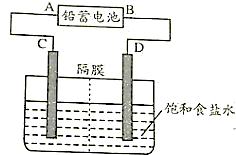
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上第三次月考化学卷(解析版) 题型:填空题
(本题满分18分)二甲 醚(CH3OCH3)是一种应用前景广阔的清洁燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:
醚(CH3OCH3)是一种应用前景广阔的清洁燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:
编号 | 热化学方程式 | 化学平衡常数 |
① | CO(g)+2H2(g) | K1 |
② | 2CH3OH(g) | K2 |
③ | CO(g)+H2O(g) | K3 |
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H﹣H | C﹣O | C=O | H﹣O | C﹣H |
E/(kJ.mol﹣1) | 436 | 343 | 1076 | 465 | 413 |
由上述数据计算△H1= ;
(2)该工艺的总反应为3CO(g)+3H2(g) CH3OCH3(g)+CO2(g)△H,该反应△H= ,化学平衡常数K= (用含K1、K2、K3的代数式表示);
CH3OCH3(g)+CO2(g)△H,该反应△H= ,化学平衡常数K= (用含K1、K2、K3的代数式表示);
(3)下列措施中,能提高CH3OCH3产率的有 ;
A.分离出二甲醚 B.升高温度
C.改用高效催化剂 D.增大压强
(4)工艺中反应①和反应②分别在不同的反应器中进行,无反应③发生.该工艺中反应③的发生提高了CH3OCH3的产率,原因是 ;
(5)以n(H2)/n(CO)=2 通入1L的反应器中,一定条件下发生反应:4H2(g)+2CO(g) CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图所示.下列说法正确的是 ;
CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图所示.下列说法正确的是 ;
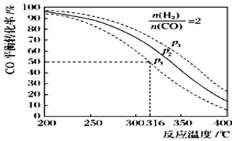
A.该反应的△H>0
B.若在p2和316℃时反应达到平衡,则CO的转化率小于50%
C.若在p3和316℃时反应达到平衡,H2的转化率等于50%
D.若在p3和316℃时,起始时n(H2)/n(CO)=3,则达平衡时CO的转化率大于50%
E.若在p1和200℃时,反应达平衡后保持温度和压强不变,再充入2mol H2和1mol CO,则平衡时二甲醚的体积分数增大
(6)某温度下,将8.0mol H2和4.0mol CO充入容积为2L的密闭容器中,发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g),反应达平衡后测得二甲醚的体积分数为25%,则该温度下反应的平衡常数K= .
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上10月月考化学试卷(解析版) 题型:选择题
下表是25℃时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是( )
化学式 | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
Ksp或Ka | Ksp=1.8×10-10 | Ksp=2.0×10-12 | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
A.相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是
c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B.碳酸钠溶液中滴加少量氯水的离子方程式H2O+2CO32-+Cl2=2HCO3-+Cl-+ClO-
C.向0.1mol/LCH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=9:5,此时溶液pH=5
D.向浓度均为1×10-3mol/L的KCl和K2CrO4混合液中滴加1×10-3mol/L的AgNO3溶液,CrO42-先形成沉淀
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
对于可逆反应N2(g)+3H2(g) 2NH3(g) △H<0,下列研究目的和示意图相符的是
2NH3(g) △H<0,下列研究目的和示意图相符的是
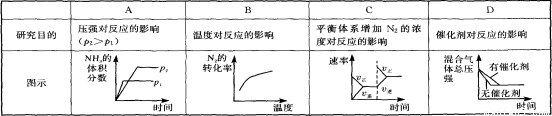
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com