
| A. | 要除去含有 A2+、Z-和B-混合溶液中的A2+,而不氧化Z-和B-,应加入Z2 | |
| B. | 还原性强弱顺序为:A2+>B->Z->X2+ | |
| C. | X2+是 XO4- 的还原产物,B2是 B-的氧化产物 | |
| D. | 在溶液中可能发生反应:XO4-+5 A2++8H+=X2++5A3++4H2O |
分析 ①2B-+Z2═B2+2Z-中,Z元素的化合价降低,B元素的化合价升高;
②2A2++B2═2A3++2B-中,A元素的化合价升高,B元素的化合价降低;
③16H++10Z-+2XO4-═2X2++5Z2+8H2O中,Z元素的化合价升高,X元素的化合价降低,结合氧化还原反应基本概念及氧化剂的氧化性大于氧化产物的氧化性、还原剂的还原性大于还原产物的还原性来解答.
解答 解:A.①2B-+Z2═B2+2Z-,氧化性:Z2>B2,
②2A2++B2═2A3++2B-,氧化性:B2>A3+,
③16H++10Z-+2XO4-═2X2++5Z2+8H2O,氧化性:XO4->Z2,
所以氧化性关系为:XO4->Z2>B2>A3+,所以要除去含有A2+、Z-和B-混合溶液中的A2+,而不氧化Z-和B-,应加入B2,故A错误;
B.由氧化性越强,对应离子的还原性越弱,由A可知氧化性关系为:XO4->Z2>B2>A3+,则还原性由强到弱的顺序是 A2+>B->Z->X2+,故B正确;
C.反应③16H++10Z-+2XO4-═2X2++5Z2+8H2O中,X元素化合价降低,被还原,则X2+是XO4- 的还原产物,①2B-+Z2=B2+2Z-,B元素化合价升高,被氧化,则B2是B-的氧化产物,故C正确;
D.由A可知氧化性关系为:XO4->Z2>B2>A3+,则在溶液中可能发生反应:XO4-+5 A2++8H+=X2++5A3++4H2O,故D正确;
故选A.
点评 本题考查氧化还原反应中氧化性的比较及相关的基本概念,明确反应中元素的化合价变化及氧化性比较方法为解答的关键,题目难度不大.


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | O |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑫ | ⑬ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 停止冬季供暖,减少有害物质排放 | |
| B. | 对锅炉和汽车等产生的有害气体和烟尘进行处理 | |
| C. | 退耕还林,改善生态环境 | |
| D. | 寻找新能源,减少化石燃料的使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 容器编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | |
| H2 | CO2 | HCOOH | |||
| Ⅰ | 150 | 0.4 | 0.4 | 0.2 | 2 |
| Ⅱ | 150 | 0.8 | 0.8 | t1 | |
| Ⅲ | 0.4 | 0.4 | 0.16 | t2 | |
| A. | 反应达到平衡时,容器Ⅰ中的平均反应速率为v(H2)=0.1mol/(L•min) | |
| B. | 反应达到平衡时,容器Ⅱ所需时间t2<2min | |
| C. | 若只改变一个反应条件,容器Ⅲ可能是加入了合适的催化剂 | |
| D. | 起始时,向容器Ⅱ中充入0.45mol H2、0.20mol CO2和0.18molHCOOH,则反应向正反应方向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
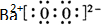 (写电子式).
(写电子式).
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
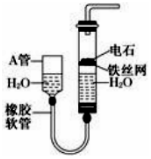 如图,图中的实验装置可用于制取乙炔.
如图,图中的实验装置可用于制取乙炔.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 太阳能电池的发展已经进入了第三代.第三代就是铜铟镓硒CIGS等化合物薄膜太阳能电池以及薄膜硅系太阳能电池.完成下列填空:
太阳能电池的发展已经进入了第三代.第三代就是铜铟镓硒CIGS等化合物薄膜太阳能电池以及薄膜硅系太阳能电池.完成下列填空:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com