
【题目】下列表示不正确的是
A. KOH的电子式:![]() B. 水分子的结构式:
B. 水分子的结构式:![]()
C. CH4的球棍模型: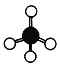 D. Cl原子的结构示意图:
D. Cl原子的结构示意图:![]()
科目:高中化学 来源: 题型:
【题目】常温下,A是由X和Y两种短周期元素组成的气体,X的原子序数小于Y,甲、乙、丙分别是X、Y、Z元素对应的单质,Z是地壳中含量最高的元素,它们有如右图所示的转化关系。下列说法不正确的是

A. X、Y、Z三种元素能组成离子化合物
B. 反应②为化合反应,反应③为置换反应
C. 常温常压下,Z的简单氢化物的熔沸点为同族最高
D. 原子半径:Y>Z>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d为四种由短周期元素构成的中性粒子,它们都有14个电子,且都是共价形分子。回答下列问题:
(1)a是单核分子,a单质可用作半导体材料,a原子核外电子排布式为____________________。
(2)b是双核化合物,常温下为无色无味气体。b的化学式为________。人一旦吸入b气体后,就易引起中毒,是因为_______________________________________________而中毒。
(3)c是双核单质,写出其电子式____________________________________________。c分子中所含共价键的类型为____________(填“极性键”或“非极性键”)。c单质常温下性质稳定,不易起反应,原因是______________________________________________。
(4)d是四核化合物,其结构式为____________________________________________;d分子内所含共价键有________个σ键,________个π键;σ键与π键的强度大小关系为σ______π(填“>”、“<”或“=”),原因是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。请回答下列问题:
(1)铁元素基态原子的电子排布式为_________,3d能级上的未成对电子数为_________,能量最高能级的电子云形状为_________。
(2)Fe3+可用KSCN溶液检验,形成的配合物颜色为_________,写出一个与SCN-具有相同空间构型的分子:_________。
(3)氮元素的最简单氢化物为氨,氨的沸点_________(填“高于”或“低于”)膦(PH3),原因是_________。氮元素另一种氢化物联氨(N2H4)是_________(填“极性”或“非极性”)分子,其中心原子的轨道杂化类型为_________。
(4)铁的第三电离能(I3),第四电离能(I4)分别为2957kJ/mol,5290kJ/mol,I4远大于I3的原因是_________。
(5)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式:_________。若两个最近的Fe原子间的距离为a cm,则该晶体的密度是_________g/cm3(设阿伏加德罗常数的值为NA)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】桥环烷烃是指共用两个或两个以上碳原子的多环烷烃,二环[1,1,0]丁烷(![]() )是最简单的一种。下列关于该化合物的说法错误的是
)是最简单的一种。下列关于该化合物的说法错误的是
A. 与1,3-丁二烯互为同分异构体
B. 二氯代物共有4种
C. 碳碳键只有单键且彼此之间的夹角有45°和90°两种
D. 每一个碳原子均处于与其直接相连的原子构成的四面体内部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨是一种混合型晶体,具有多种晶体结构其一种晶胞的结构如图所示。回答下列问题:

(1)基态碳原子的轨道表示式为___________;
(2)碳、氮、氧三种元素的第一电离能由大到小的顺序为___________;
(3)CH3-是有机反应中重要的中间体,其空间构型为___________;
(4)石墨晶体中碳原子的杂化形式为___________晶体中微粒间的作用力有___________(填标号),石墨熔点高于金刚石是因为存在___________(填标号);
A.离子键 B.共价键 C.π键 D.氢键 E范德华力
(5)该晶胞中的碳原子有___________种原子坐标;若该晶胞底面边长为apm,高为cpm,则石墨晶体中碳碳键的键长为___________pm,密度为___________g·cm-3(设阿伏加德罗常数的值为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温25℃下,向一定量的0.1mol/L的BOH溶液中逐滴滴入稀盐酸。溶液中水电离出的氢离子浓度的负对数[用pC表示,pC=-1gc(H+)水]与加入盐酸体积的关系如图所示。下列叙述错误的是( )

A. BOH为弱碱且Kb的数量级为10—5
B. b点溶液呈中性
C. c-d点间溶液中:c(BOH)+c(OH—)>c(H+)
D. c点溶液中水的电离程度最大,且c(B+)<c(Cl—)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PbCl2是一种重要的化工材料,常用作助溶剂、制备铅黄等染料。工业生产中利用方铅矿精矿(主要成分为PbS,含有FeS2等杂质)和软锰矿(主要成分为MnO2)制备PbCl2的工艺流程如图所示。

已知:i. PbCl2微溶于水ii. PbCl2 (s) + 2Cl-(aq) ![]() PbCl42-(aq) ΔH > 0
PbCl42-(aq) ΔH > 0
(1)浸取过程中MnO2与PbS发生如下反应,请将离子反应配平:
___ ____+ ___ ____+___PbS + ___MnO2 ____PbCl2 + ____ ____+ ____ ____+ ___ ____
(2)由于PbCl2微溶于水,容易附着在方铅矿表面形成“钝化层”使反应速率大大降低,浸取剂中加入饱和NaCl溶液可有效避免这一现象,原因是________。
(3)调pH的目的是________。
(4)沉降池中获得PbCl2采取的措施有________。
(5)通过电解酸性废液可重新获得MnO2,装置示意图如下:

①在_______极(填“a”或“b”)获得MnO2,电极反应为________。
②电解过程中发现有Cl2产生,原因可能是_________、__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T ℃时,在容积为0.5 L的密闭容器中发生如下反应:mA(g)+nB(g) ![]() pC(g)+qD(s) ΔH<0(m、n、p、q为最简整数比)。A、B、C、D的物质的量变化如图所示。
pC(g)+qD(s) ΔH<0(m、n、p、q为最简整数比)。A、B、C、D的物质的量变化如图所示。

(1)前3 min,v(C)=______________。
(2)在该温度下K= ___________(填数值)
(3)反应达到平衡后,下列措施对A的转化率无影响的是________(填选项字母)。
A.保持体积不变,再通入2 mol A和1 mol B B.移走一部分D C.把容器的体积缩小一倍 D.升高温度
(4)T ℃时,容积为1 L的密闭容器中,起始时充入0.2molA、0.4molB、0.3molC、0.5molD,此时v(正)_____v(逆) (填“>”“<”或“=”) 。判断的依据是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com