
【题目】以烃A为主要原料,采用以下路线合成药物X、Y和高聚物Z。
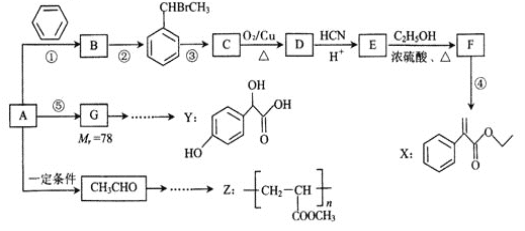
已知:

Ⅱ.反应①、反应②、反应⑤的原子利用率均为100%。
请回答下列问题:
(1)B的名称为______________。
(2)X中的含氧官能团名称为____,反应③的条件为_______,反应③的反应类型是_________。
(3)关于药物Y 的说法正确的是_________________。
的说法正确的是_________________。
A.药物Y的分子式为C8H804,遇氯化铁溶液可以发生显色反应
B.1mol药物Y与H2、浓溴水中的Br2反应,最多消耗分别为4 mol和2 mol
C.1mol药物Y与足量的钠反应可以生成33.6 L氢气
D.药物Y中⑥、⑦、⑧三处- OH的电离程度由大到小的顺序是⑧>⑥>⑦
(4)写出反应E-F的化学方程式_____________________________________。
(5)写出符合下列条件的E的所有同分异构体的结构简式________________________。
①属于酚类化合物,且是苯的对位二元取代物;②能发生银镜反应和水解反应。
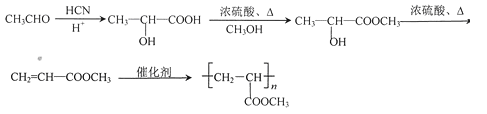
(6)设计一条以CH3CHO为起始原料合成Z的线路(无机试剂及溶剂任选) ___________________
【答案】 苯乙烯 酯基 NaOH水溶液、加热 消去反应 AD 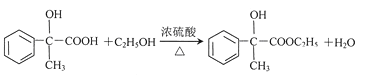
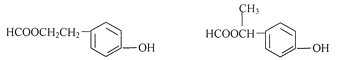
【解析】反应①、反应②、反应⑤的原子利用率均为100%,属于加成反应,结合反应②的产物,可知烃A为HC≡CH,B为![]() ,而G的相对分子质量为78,则G为
,而G的相对分子质量为78,则G为![]() .C可以发出催化氧化生成D,D发生信息中I的反应,则反应③为卤代烃在氢氧化钠水溶液、加热条件下发生的水解反应,则C为
.C可以发出催化氧化生成D,D发生信息中I的反应,则反应③为卤代烃在氢氧化钠水溶液、加热条件下发生的水解反应,则C为![]() ,D为
,D为![]() ,E为
,E为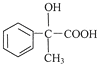 ,F为
,F为![]() ,F在浓硫酸、加热条件下发生消去反应得到X;
,F在浓硫酸、加热条件下发生消去反应得到X;
(1)B为![]() ,名称为苯乙烯;
,名称为苯乙烯;
(2)X中的含氧官能团名称为酯基,反应③的条件为:氢氧化钠水溶液、加热,反应③的反应类型是取代反应;
(3)关于药物Y(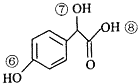 ),
),
A.药物Y的分子式为C8H804,含有酚羟基,遇氯化铁溶液可以发生显色反应,故A正确;B.苯环与氢气发生加成反应,1mol药物Y与3molH2加成,Y中酚羟基的邻位能与浓溴水发生取代反应,1molY消耗2molBr2,故B错误;C.羟基、羧基能与钠反应生成氢气,1mol药物Y与足量的钠反应可以生成1.5mol氢气,标况下氢气体积为33.6L,但氢气不一定处于标况下,故C错误;D.羧基酸性最强,酚羟基酸性很弱,醇羟基表现为中性,药物Y中⑥、⑦、⑧三处-OH的电离程度由大到小的顺序是⑧>⑥>⑦,故D正确;故选AD;
(4)反应E-F的化学方程式: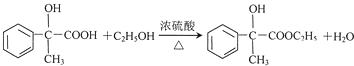 ;
;
(5)E( )同分异构体的符合下列条件:①属于酚类化合物,且是苯的对位二元取代物;②能发生银镜反应和水解反应,含有甲酸形成的酯基,符合条件的同分异构体有:
)同分异构体的符合下列条件:①属于酚类化合物,且是苯的对位二元取代物;②能发生银镜反应和水解反应,含有甲酸形成的酯基,符合条件的同分异构体有: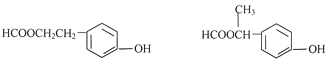 ;
;
(6)乙醛与HCN发生加成反应、酸性条件下水解得到![]() ,与甲醇反应酯化反应生成
,与甲醇反应酯化反应生成![]() ,在浓硫酸、加热条件下发生消去反应生成CH2=CHCOOCH3,最后发生加聚反应得到
,在浓硫酸、加热条件下发生消去反应生成CH2=CHCOOCH3,最后发生加聚反应得到![]() ,合成路线流程图为:
,合成路线流程图为: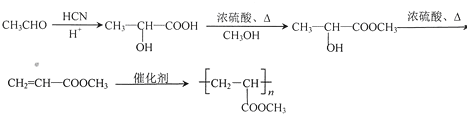 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】可以充分说明反应 P(g)+Q(g)![]() R(g)+S(g)在恒温下已达到平衡的是
R(g)+S(g)在恒温下已达到平衡的是
A.反应容器内的压强不随时间改变
B.反应容器内P、Q、R、S四者浓度之比为1︰1︰1︰1
C.P的生成速率和S的生成速率相等
D.反应容器内的气体总物质的量不随时间变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。反应A:4HCl+O2![]() 2Cl2+2H2O
2Cl2+2H2O
已知:ⅰ.反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
ⅱ.
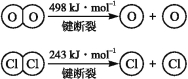
(1)反应A的热化学方程式是 。
(2)断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为 kJ,H2O中H—O键比HCl中H—Cl键(填“强”或“弱”) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学选修5:有机化学基础
有机物H(C25H44O5)是一种新型治疗高血压病的药物,工业上以淀粉、烃A为基本原料合成H的路线如下图所示。

巳知:(i)烃A在质谱图中的最大质荷比为72,B分子中核磁共振氢谱有2个峰且面积比为9:2。
(ii)  。
。
(iii)反应③中发生反应的E、G物质的量之比为4:1。
(1)A的分子式为_____;B的名称是_______;C的结构简式为_______。
(2)反应②的类型是______;F中的官能团名称是_______。
(3)写出反应①的化学方程式:___________。
(4)E有多种同分异构体,其中满足下列条件的同分异构体共有____种,核磁共振氢谱有4个峰的物质结构简式为__________。
①能发生银镜反应 ②能与单质钠发生反应
(5)1,3-丁二烯是一种重要化工原料,以乙醛为基本原料可制得该烃,请写出相应的转化流程图:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验事实:
(1)X+Y2+===X2++Y
(2)Z+2H2O![]() Z(OH)2+H2↑
Z(OH)2+H2↑
(3)Z2+离子的氧化性比X2+弱
(4)由Y、W作电极组成的原电池反应为:Y-2e-===Y2+
由此可知,X、Y、Z、W的还原性由强到弱的顺序是()
A. X>Y>Z>W B. Y>X>W>Z
C. Z>X>Y>W D. Z>Y>X>W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳的回收利用是环保领域研究的热点课题。
(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如图1所示,其总反应的化学方程式为_________。

(2)CO2经过催化氢化合成低碳烯烃.其合成乙烯的反应为2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g)△H,几种物质的能量(在标准状况下,规定单质的能量为0,测得其他物质在生成时所放出或吸收的热量)如下表所示:
CH2=CH2(g)+4H2O(g)△H,几种物质的能量(在标准状况下,规定单质的能量为0,测得其他物质在生成时所放出或吸收的热量)如下表所示:
物质 | H2(g) | CO2(g) | CH2=CH2(g) | H2O(g) |
能量/kJmol-1 | 0 | -394 | 52 | -242 |
则△H=_________。
(3)在2L恒容密闭容器中充入2molCO2和nmolH2,在一定条件下发生(2)中的反应,CO2的转化率与温度、投料比[X= ![]() ]的关系如图2所示。
]的关系如图2所示。
①X1_________X2(填“>”、“<”或“=”,下同),平衡常数KA_________KB.
②若B点的投料比为3,且从反应开始到B点需要10min,则v(H2)=_________。
(4)以稀硫酸为电解质溶液,利用太阳能将CO2转化为低碳烯烃,工作原理图如图3。
①b电极的名称是_________;
②产生丙烯的电极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
I.高铁酸钾( K2Fe04)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图1是高铁电池的模拟实验装置:
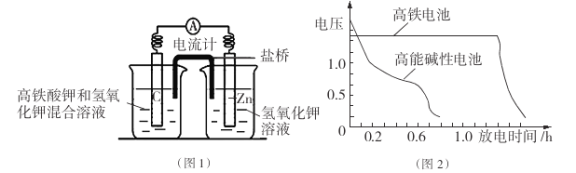
(1)该电池放电时正极的电极反应式为 ;若维持电流强度为1A,电池工作十分钟,理论消耗Zn g(已知F="96500" C/mol)。
(2)盐桥中盛有饱和KC1溶液,此盐桥中氯离子向 移动(填“左”或“右”);若用阳离子交换膜代替盐桥,则钾离子向 移动(填“左”或“右”)。
(3)图2为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有
Ⅱ.工业上湿法制备K2Fe04的工艺流程如图3。
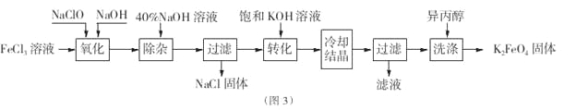
(4)完成“氧化”过程中反应的化学方程式:
![]()
其中氧化剂是 (填化学式)。
(5)加入饱和KOH溶液的目的是
(6)已知25℃时Ksp[Fe(OH)3]=4.0×![]() ,此温度下若在实验室中配制5mol/L l00mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入 mL 2 mol/L的盐酸(忽略加入盐酸体积)。
,此温度下若在实验室中配制5mol/L l00mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入 mL 2 mol/L的盐酸(忽略加入盐酸体积)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是 ( )
A. 催化剂能够改变化学反应路径 B. 升高温度提高了活化分子百分数
C. 增大反应物浓度提高了活化分子百分数 D. 增大压强能增大活化分子的浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com