
【题目】下列解释事实的离子方程式正确的是
A.向NaClO溶液中通入少量CO2制取次氯酸:ClO-+H2O+CO2=HClO+HCO3-
B.电解MgCl2溶液:2H2O+2Cl-![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
C.Ca(HCO3)2溶液中加入足量的NaOH溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O
D.铁和稀硝酸反应制得浅绿色溶液:Fe+4H++NO3-=Fe3++NO↑+2H2O
【答案】A
【解析】
A.次氯酸的酸性强于碳酸氢根弱于碳酸,所以即便少量二氧化碳通入次氯酸钠溶液也只能生成碳酸氢根,离子方程式为ClO-+H2O+CO2=HClO+HCO3-,故A正确;
B.镁离子会和氢氧根生成沉淀,正确离子方程式为2H2O+Mg2++2Cl-![]() Mg(OH)2↓+H2↑+Cl2↑,故B错误;
Mg(OH)2↓+H2↑+Cl2↑,故B错误;
C.Ca(HCO3)2溶液中加入足量的NaOH溶液,碳酸氢根完全反应,离子方程式为Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-,故C错误;
D.铁和稀硝酸反应制得浅绿色溶液,说明铁过量生成Fe2+,离子方程式为3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O,故D错误;
故答案为A。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A.丙烯的结构简式为CH2CHCH3
B.分子式为C4H10O属于醇类的有机物有4种
C.分子式为C2H4O2和C3H6O2的有机物一定互为同系物
D.![]() 名称为丙酸甲酯
名称为丙酸甲酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用浓硫酸和乙醇反应制备乙稀,若温度过高或加热时间过长,制得的乙稀往往混有CO2、SO2、H2O(气体少量)。请回答下列问题:
(1)试分析CO2和SO2 是怎么样产生的?_____(用一句话说明)。
(2)试用下图所示的装置设计一个实验,验证制得的气体中确实含有CO2和SO2、H2O(g) ,按气流的方向,各装置的连接顺序是:__________。
① |
② |
③ |
④ |
(3)实验时若观察到:①中A瓶中溶液褪色,B瓶中深水颜色逐渐变浅,C瓶中溶液不褪色,则A瓶的作用是___________,B瓶的作用是________, C瓶的作用是____________。
(4)装置②中所加的试剂名称是__________,它可以验证的气体是__________,简述确定装置②在整套装置中的位置的理由是______________。
(5)装置③中所盛溶液的名称是__________,它可以用来验证的气体是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g) ![]() Ni(CO)4(g),已知该反应平衡常数与温度的关系如表所示:
Ni(CO)4(g),已知该反应平衡常数与温度的关系如表所示:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法正确的是( )
A. 上述生成Ni(CO)4(g)的反应为吸热反应
B. 25 ℃时反应Ni(CO)4(g) ![]() Ni(s)+4CO(g)的平衡常数为0.5
Ni(s)+4CO(g)的平衡常数为0.5
C. 在80 ℃时,测得某时刻,Ni(CO)4、CO浓度均0.5 mol/L,则此时v正>v逆
D. 80 ℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素![]() 在元素周期表中的相对位置如图所示,其中w原子的最外层电子数是最内层电子数的3倍.下列判断不正确的是
在元素周期表中的相对位置如图所示,其中w原子的最外层电子数是最内层电子数的3倍.下列判断不正确的是![]()

A.x与同主族且相邻元素的气态氢化物的沸点,前者高于后者
B.含Y元素的盐溶液有的显酸性,有的显碱性
C.x的气态氢化物与w的最高价氧化物的水化物反应只能生成一种盐
D.x与H、O元素形成的化合物可以组成一种盐,其中![]() 元素原子个数之比为2:4:3
元素原子个数之比为2:4:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中![]() 下列分析正确的是
下列分析正确的是![]()
![]()

A. ![]() 闭合,铁棒上发生的反应为
闭合,铁棒上发生的反应为![]()
B. ![]() 闭合,石墨棒周围溶液pH逐渐降低
闭合,石墨棒周围溶液pH逐渐降低
C. ![]() 闭合,铁棒不会被腐蚀,属于外加电流的阴极保护法
闭合,铁棒不会被腐蚀,属于外加电流的阴极保护法
D. ![]() 闭合,电路中通过
闭合,电路中通过![]() 个电子时,两极共产生
个电子时,两极共产生![]() 气体
气体
查看答案和解析>>
科目:高中化学 来源: 题型:
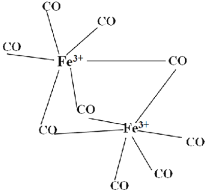
【题目】羰基铁[Fe(CO)5]广泛用于催化剂,汽油抗爆剂,电子工业高频线圈制造。请回答下列问题:
(1)羰基铁[Fe(CO)5]中,碳、氧电负性大小比较____(用元素符号表示)。写出基态O的轨道表示式____;
(2)CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO分子中C原子的杂化类型为____杂化。
(3)1molFe(CO)5分子中含σ键数目为____;CO配体中的配位原子是____。
(4)科学家通过X射线探明,FeO、MgO、CaO的晶体结构与NaCl晶体结构相似,比较晶体熔点的高低MgO____CaO(填“高于”或“低于”)
(5)羰基铁[Fe(CO)5]中铁为0价。如图中的羰基铁为+3价,此羰基铁的晶体类型为____;此羰基铁中每个铁的配位数是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向50mL含有0.1molCl2的氯水中滴加2mol·L1的NaOH溶液,得到溶液pH随加入NaOH溶液体积的变化如图所示。下列说法正确的是
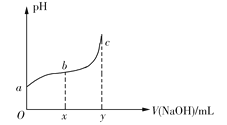
A.若a点pH=4,且c(Cl)=mc(HClO),则HClO的电离平衡常数为![]()
B.若x=100,b点对应溶液中,c(OH)>c(H+),可用pH试纸测定其pH
C.若y=200,c点对应溶液中,c(OH)c(H+)=2c(Cl)+c(HClO)
D.b→c段,随NaOH溶液的滴入,![]() 逐渐增大
逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是

A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com