
分析 (1)平衡常数为生成物离子(或分子)浓度系数次幂之积除以反应物离子(或分子)浓度系数次幂之积反应;
(2)Mg(OH)2的溶度积为镁离子浓度与氢氧根离子浓度平方的乘积;
(3)醋酸是弱电解质,加水稀释醋酸溶液,促进醋酸电离,醋酸电离产生的醋酸根离子和氢离子数目增多浓度减小,根据醋酸的电离程度确定溶液中微粒个数变化.
解答 解:(1)平衡常数为生成物离子(或分子)浓度系数次幂之积除以反应物离子(或分子)浓度系数次幂之积反应,则反应Cl2+H2O?H++Clˉ+HClO其化学平衡常数K的表达式为:K=$\frac{c({H}^{+})•c(C{l}^{-})•c(HClO)}{c(C{l}_{2})}$;
故答案为:K=$\frac{c({H}^{+})•c(C{l}^{-})•c(HClO)}{c(C{l}_{2})}$;
(2)Mg(OH)2的溶度积为镁离子浓度与氢氧根离子浓度平方的乘积,则Mg(OH)2的溶度积表达式为:Ksp=c(Mg2+)•c2(OH-);
故答案为:Ksp=c(Mg2+)•c2(OH-);
(3)A、醋酸是弱电解质,加水稀释醋酸溶液,促进醋酸电离,醋酸电离产生的醋酸根离子和氢离子数目增多,故A错误;
B、加水稀释,促进电离,但离子浓度降低,故B错误;
C、$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$=$\frac{{K}_{a}}{{K}_{W}}$,电离平衡常数和水的离子积常数不变,所以其不变,故C正确;
D、醋酸电离产生的醋酸根离子和氢离子数目增多,水电离的氢离子数目增大,则$\frac{c(C{H}_{3}CO{O}^{-})}{c({H}^{+})}$减小,故D正确;
故答案为:CD.
点评 本题考查了平衡常数的表达式、溶度积常数的表达式、弱电解质溶液加水稀释过程中离子浓度的变化,注意醋酸在稀释时电离产生的醋酸根离子和氢离子数目增多浓度减小,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)T℃时,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图所示,根据图示可知:A与B反应生成C的化学方程式为A(g)+3B(g)?2C(g).
(1)T℃时,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图所示,根据图示可知:A与B反应生成C的化学方程式为A(g)+3B(g)?2C(g).| 时间/s n/mol | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 | |
| B. | 苯酚钠溶液中通入少量CO2,可以生成苯酚和碳酸钠 | |
| C. | 乙烷和丙烯的物质的量共1 mol,完全燃烧生成3 mol H2O | |
| D. | 光照下2,2─二甲基丙烷与Br2反应,其一溴取代物只有一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化合物A、B可合成荧光“魔棒”中产生能量的物质之一(CPPO).
化合物A、B可合成荧光“魔棒”中产生能量的物质之一(CPPO).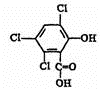 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 W、X、Y、Z、M、G六种主族元素分属三个短周期,且原子序数依次增大.Y是地壳中含量最多的元素;M与Y同主族;G与Z形成的化合物是厨房常用的调味品;X的简单气态氢化物水溶液呈碱性.请回答下列问题:
W、X、Y、Z、M、G六种主族元素分属三个短周期,且原子序数依次增大.Y是地壳中含量最多的元素;M与Y同主族;G与Z形成的化合物是厨房常用的调味品;X的简单气态氢化物水溶液呈碱性.请回答下列问题: ,W、Y、Z、M、G形成的简单离子的半径大小顺序是S2->Cl->O2->Na+>H+(用相应的离子符号表示).
,W、Y、Z、M、G形成的简单离子的半径大小顺序是S2->Cl->O2->Na+>H+(用相应的离子符号表示).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com