
| A. | 都具有金属光泽 | B. | 都是强还原剂 | ||
| C. | 焰色反应现象相同 | D. | 电子层结构相同 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
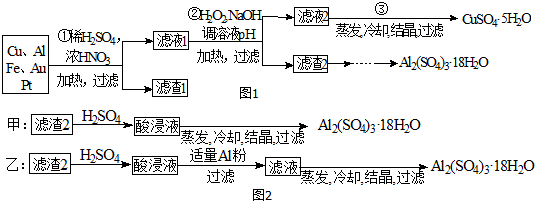
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
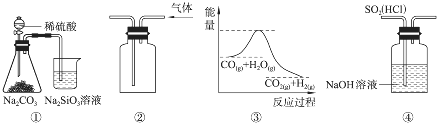
| A. | 图④装置可以用来除去SO2中的HCl | |
| B. | 用图②所示实验装置排空气法收集CO2气体 | |
| C. | 图③表示可逆反应CO(g)+H2O(g)?CO2(g)+H2(g)的△H大于0 | |
| D. | 图①所示实验可比较硫、碳、硅三种元素的非金属性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 | 药品 | 制取气体 | 量气管中的液体 |
| Ⅰ | Cu、稀HNO3 | H2O | |
| Ⅱ | NaOH固体、浓氨水 | NH3 | |
| Ⅲ | Na2SO3固体、浓H2SO4 | SO2 | |
| Ⅳ | 镁铝合金、NaOH溶液(足量) | H2 | H2O |
| 编号 | 镁铝合金度量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 1.0g | 10.0mL | 346.3mL |
| ② | 1.0g | 10.0mL | 335.0mL |
| ③ | 1.0g | 10.0mL | 345.7mL |
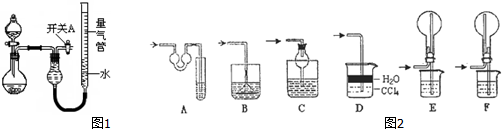
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等体积、等浓度的KHSO4溶液与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| B. | 在次氯酸中加入碳酸钠:2HClO+CO32-═2ClO-+H2O+CO2↑ | |
| C. | 钾与水反应:2K+2H2O═2K++2OH-+H2↑ | |
| D. | 氯化钠溶液中通入氟气:F2+2Cl-═2F-+Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源:2017届山西省高三上期中化学试卷(解析版) 题型:选择题
下列溶液配制实验的描述完全正确的是
A. 在容量瓶中先加入一定体积的水,再加入浓硫酸配制准确浓度的稀硫酸
B. 用浓盐酸配制1 : 1(体积比)的稀盐酸(约6mol.L-1)通常需要用容量瓶等仪器
C. 配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4以防水解
D. 用pH=1的盐酸配制100mL、pH ="2" 的盐酸所需全部玻璃仪器有100mL容量瓶、烧杯、玻璃棒、胶头滴管
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com