
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | M层上有2对成对电子 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
| J | J的气态氢化物与J的最高价氧化物对应的水化物可反应生成一种盐 |
 .
.分析 X、Y、Z、W、J是元素周期表前四周期中的四种常见元素,X的基态原子核外3个能级上有电子,且每个能级上的电子数相同,X原子核外电子排布式为1s22s22p2,则X为碳元素;Y原子的M层上有2对成对电子,原子核外电子排布式为1s22s22p63s23p4,则Y为S元素;Z和Y同周期,Z的电负性大于Y,则Z为Cl元素;W的一种核素的质量数为63,中子数为34,则其质子数=63-34=29,则W为Cu元素;J的气态氢化物与J的最高价氧化物对应的水化物可反应生成一种盐,则J为N元素,据此解答.
解答 解:X、Y、Z、W、J是元素周期表前四周期中的四种常见元素,X的基态原子核外3个能级上有电子,且每个能级上的电子数相同,X原子核外电子排布式为1s22s22p2,则X为碳元素;Y原子的M层上有2对成对电子,原子核外电子排布式为1s22s22p63s23p4,则Y为S元素;Z和Y同周期,Z的电负性大于Y,则Z为Cl元素;W的一种核素的质量数为63,中子数为34,则其质子数=63-34=29,则W为Cu元素;J的气态氢化物与J的最高价氧化物对应的水化物可反应生成一种盐,则J为N元素.
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是146C,故答案为:146C;
(2)元素Y为S元素,位于元素周期表第三周期第VIA族,故答案为:三、VIA;
(3)元素Z为Cl,原子最外层共有17种不同运动状态的电子,故答案为:17;
(4)W为Cu,基态原子核外电子排布式是1s22s22p63s23p63d104s1,W的基态原子核外价电子排布图是 ,
,
故答案为:1s22s22p63s23p63d104s1; ;
;
(5)同周期自左而右非金属性增强,非金属性较强的是Cl,列表述中能证明这一事实的是.
a.常温下,Y的单质与Z的单质状态属于物理性质,不能比较非金属性强弱,故a错误;
b.等物质的量浓度的氢化物水溶液的酸性不能比较元素非金属性强弱,故b错误;
c.Z的电负性大于Y,说明Z的非金属性更强,故c正确;
d.元素非金属性越强,对应氢化物越稳定,故d正确;
e.非金属性强弱与获得电子难易程度有关,与获得电子数目多少无关,故e错误;
f.元素的非金属性越强,对应元素最高价氧化物对应水化物的酸性越强,故f正确,
故答案为:Cl;cdf;
(6)元素的非金属性越强,对应元素最高价氧化物对应水化物的酸性越强,故酸性HClO4>H2SO4,同种元素含氧酸中元素化合价越高,酸性越强,故酸性:HClO<HClO3<HClO4,
故答案为:HClO4>H2SO4;<、<;
(7)J的气态氢化物为NH3,N原子形成3个N-H键、含有一个孤对电子,杂化轨道数目为4,中心原子的杂化方式是sp3,该原子形成的单质分子为N2,与氮气分子互为等电子体的常见分子为CO,
故答案为:sp3;CO.
点评 本题考查结构性质位置关系应用,涉及核外电子排布、元素周期律、杂化方式判断与等电子体等,难度中等,推断元素是解题关键,注意掌握金属性、非金属性强弱比较实验事实.


 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:解答题
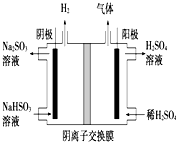 硫酸工业用SO2制取SO3的反应为:2SO2+O2 $?_{加热}^{催化剂}$2SO3△H=-47kJ/mol.不同温度下,反应的平衡常数如表:
硫酸工业用SO2制取SO3的反应为:2SO2+O2 $?_{加热}^{催化剂}$2SO3△H=-47kJ/mol.不同温度下,反应的平衡常数如表:| 温 度 | 200℃300℃400℃ |
| 平衡常数 | K1 K2 K3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S) | |
| B. | Na2CO3溶液:c(Na+)+c(H+)=2c(CO32-)+c(OH-) | |
| C. | 氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-) | |
| D. | 溶有等物质的量NaClO、NaHCO3的溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A. | 反应在t1min内的平均速率为v(H2)=$\frac{0.40}{t_1}$mol/(L•min) | |
| B. | 保持其他条件不变,起始时向容器中充入0.60molCO和1.20molH2O,到达平衡时n(CO2)=0.40 mol | |
| C. | 保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小 | |
| D. | 温度升至1000℃,上述反应平衡常数为1.6,则正反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molO2在任何情况下都是32g | B. | 摩尔是一个基本物理量 | ||
| C. | H2SO4的摩尔质量是98g | D. | 1摩尔氢的质量是2g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 颜色、性质 | 物质 | 颜色、性质 | |
| 氢氧化铜Cu(OH)2 | 蓝色固体不溶于水 | 硫酸铜(CuSO4) | 溶液呈蓝色 | |
| 氧化亚铜(Cu2O) | 红色固体不溶于水 | 氯化铜(CuCl2) | 浓溶液呈绿色,稀溶液呈蓝色 | |
| 氯化亚铜(CuCl) | 白色固体不溶于水 | 碱式氯化铜 | 绿色固体不溶于水 |
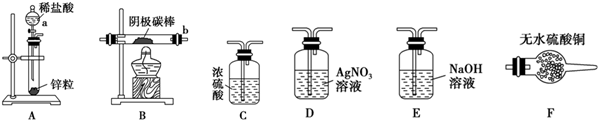
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com