
(19分) (1)利用H2S废气制取氢气的方法有多种。
①高温热分解法:已知:H2S(g)  H2(g)+1/2S2(g)ΔH在恒容密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol/L测定H2S的转化率,结果见图。
H2(g)+1/2S2(g)ΔH在恒容密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol/L测定H2S的转化率,结果见图。
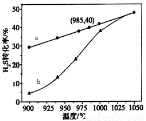
图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。ΔH_____0(填>,=或<):说明随温度的升高,曲线b向曲线a靠近的原因:________________________。
②电化学法:该法制氢过程的示意图如图。
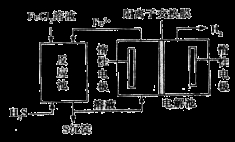
反应池中反应的离子方程式是_____________________________;
反应后的溶液进入电解池,电解总反应的离子方程式为___________________________________。
(2)以Al和NiO(OH)为电极,NaOH溶液为电解液可以组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2。
①该电池的负极反应式__________________。②电池总反应的化学方程式__________________。
(3)某亚硝酸钠固体中可能含有碳酸钠和氢氧化钠,现测定亚硝酸钠的含量。
已知:5NaNO2+2KMnO4+3H2SO4=5NaNO3+2MnSO4+K2SO4+3H2O
称取4.000g固体,溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L,酸性KMnO4溶液进行滴定,实验所得数据如下表所示;
滴定次数 | 1 | 2 | 3 | 4 |
KMnO4溶液的体积/ml | 20.60 | 20.02 | 20.00 | 19.98 |
①滴入最后一滴酸性KMnO4溶液,溶液___________,30秒内不恢复,可判断达到滴定终点。
②第一组实验数据出现异常,造成这种异常的原因可能是____________(填序号)。
A.酸式滴定管用蒸馏水洗净后未用标准液润洗;
B.锥形瓶洗净后未干燥;
C.滴定终了仰视读数
③根据表中数据,计算所得固体中亚硝酸钠的质量分数_____________。
(19分)(1) ① >(2分),温度升高,反应速率加快,达到平衡所需的时间缩短(或温度升高,反应速率加快,相同时间内更快达到平衡) (2分)
②2Fe3+ + H2S== 2Fe2++S↓+2H+(2分)2Fe2+ + 2H+ 2Fe3++H2↑(2分)
2Fe3++H2↑(2分)
(2)①Al-3e- + 4OH-==AlO2-+2H2O (2分)
②Al+3NiO(OH)+NaOH+3H2O=Na AlO2+3Ni(OH)2 (2分)
(3)①由无色变为紫红色(2分);② A、C (2分;③86.25%(3分);
【解析】
试题分析:(1) ①根据图像a可知:升高温度,H2S的平衡转化率增大,说明升高温度,平衡正向移动,正反应方向是吸热反应,所以ΔH>0;随温度的升高,曲线b向曲线a靠近的原因是温度升高,反应速率加快,达到平衡所需的时间缩短,所以曲线b向曲线a靠近;②根据图示可知:在反应池中反应的离子方程式是2Fe3+ + H2S== 2Fe2++S↓+2H+;反应后的溶液中含有FeCl2、HCl把它们加入进电解池,由于阳离子放电能力:H+> Fe2+,所以在阴极发生反应:2H++2e-=H2↑;离子的放电能力:Fe2+>Cl->OH-,所以在阳极发生反应:2Fe2+-2e-= 2Fe3+↑;电解总反应的离子方程式为2Fe2+ + 2H+ 2Fe3++H2↑; (2) ①以Al和NiO(OH)为电极,NaOH溶液为电解液可以组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2。由于活动性:Al> NiO(OH),所以Al为负极,该电池的负极反应式是Al-3e-+ 4OH-=AlO2-+2H2O;②电池总反应的化学方程式是Al+3NiO(OH)+NaOH+3H2O=Na AlO2+3Ni(OH)2 ;(3) ①NaNO2有还原性,KMnO4有氧化性,二者会发生氧化还原反应而使酸性KMnO4溶液的紫色褪去,因此滴入最后一滴酸性KMnO4溶液,溶液由无色变为紫红色,半分钟内不褪色,可判断达到滴定终点。②A.酸式滴定管用蒸馏水洗净后未用标准液润洗;则同样的还原剂消耗的KMnO4溶液体积偏大,正确;B.锥形瓶洗净后未干燥,由于反应物的物质的量不变,所以对测定的物质浓度不产生影响,错误;C.滴定终了仰视读数,会是消耗的氧化剂的溶液体积偏大,正确;③根据表中数据,可知第一次误差太大,舍去,V(KMnO4)= (20.02+20.00+19.98)÷3=20.00ml;n(KMnO4)= V(KMnO4)×0.1000mol/L= 0.02L × 0.1000mol/L=2×10-3mol,则根据方程式中物质之间的物质的量关系可知n(NaNO2)= 5/2 n(KMnO4)= 5×10-3mol,所以所得固体中亚硝酸钠的质量分数是[(5×10-3mol×69g/mol) ×10]÷4.000g =3.450g÷ 4.000g=86.25%。
2Fe3++H2↑; (2) ①以Al和NiO(OH)为电极,NaOH溶液为电解液可以组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2。由于活动性:Al> NiO(OH),所以Al为负极,该电池的负极反应式是Al-3e-+ 4OH-=AlO2-+2H2O;②电池总反应的化学方程式是Al+3NiO(OH)+NaOH+3H2O=Na AlO2+3Ni(OH)2 ;(3) ①NaNO2有还原性,KMnO4有氧化性,二者会发生氧化还原反应而使酸性KMnO4溶液的紫色褪去,因此滴入最后一滴酸性KMnO4溶液,溶液由无色变为紫红色,半分钟内不褪色,可判断达到滴定终点。②A.酸式滴定管用蒸馏水洗净后未用标准液润洗;则同样的还原剂消耗的KMnO4溶液体积偏大,正确;B.锥形瓶洗净后未干燥,由于反应物的物质的量不变,所以对测定的物质浓度不产生影响,错误;C.滴定终了仰视读数,会是消耗的氧化剂的溶液体积偏大,正确;③根据表中数据,可知第一次误差太大,舍去,V(KMnO4)= (20.02+20.00+19.98)÷3=20.00ml;n(KMnO4)= V(KMnO4)×0.1000mol/L= 0.02L × 0.1000mol/L=2×10-3mol,则根据方程式中物质之间的物质的量关系可知n(NaNO2)= 5/2 n(KMnO4)= 5×10-3mol,所以所得固体中亚硝酸钠的质量分数是[(5×10-3mol×69g/mol) ×10]÷4.000g =3.450g÷ 4.000g=86.25%。
考点:考查温度与化学反应速率、化学平衡的关系、原电池和电解池的反应原理的应用、电极反应式的书写、滴定终点的判断、误差分析、滴定法在物质含量测定的应用的知识。


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源:2014-2015学年宁夏银川市高三上学期第三次月考理综试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.碳酸氢钙溶液和过量氢氧化钙溶液混合:Ca2++2HCO3-+OH-=CaCO3↓+CO32-+H2O
B.CuCl2溶液与Na2S溶液2:1反应,Cu2++ S2-= CuS↓
C.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO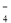 + 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
+ 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
D.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH -=2 Al(OH)3↓+3BaSO4↓
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省德阳市高三一诊考试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列叙述正确的是
A.1.7 g羟基所含电子的数目为NA
B.0.1 mol丙烯醛中含有双键的数目为0.1NA。
C.室温时,pH=13的1.0L Ba(OH)2溶液中含有OH-的数目为0.2NA
D.标准状况下,7.8 g苯中含氢原子的数目为0.6NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省日照市高三12月校际联合检测化学试卷(解析版) 题型:选择题
五种短周期元素在周期表中的位置如图所示,其中Z元素原子的最外层电子数等于电子层数。下列判断正确的是
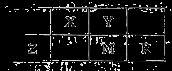
A.Z的氧化物可以做光导纤维
B.气态氢化物稳定性:M>R
C.最高价氧化物对应水化物的酸性:Y>X
D.Z、M、R的原子半径依次增大,最高化合价依次升高
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省日照市高三12月校际联合检测化学试卷(解析版) 题型:选择题
下列关于物质的性质与应用相对应的是
A.氯气有毒,不可用作自来水的杀菌消毒
B.FeCl3溶液能与Cu反应,可用于蚀刻印刷电路
C.硫粉具有还原性,可用于制造黑火药
D.Na2O2具有强氧化性,可用作呼吸面具的供氧剂
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高密市高三12月检测理综化学试卷(解析版) 题型:选择题
CO2中的一个O原子被S原子代替后,即为羰基硫(OCS),羰基硫是一种有臭鸡蛋气味的无色气体,高温下分解为CO和S。下列有关说法正确的是
A.OCS中S的化合价为+4价
B.羰基硫分解时,CO是氧化产物
C.每有1mol OCS分解,能生成22.4LCO
D.OCS中含有共价键,属于非电解质
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省英文学校高三上学期12月月考化学试卷(解析版) 题型:填空题
(12分)金属冶炼和处理常涉及许多反应。
(1)由下列物质冶炼相应金属时采用电解法的是______
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
(2)辉铜矿(Cu2S)可发生反应2Cu2S + 2H2SO4 + 5O2 = 4CuSO4 + 2H2O,该反应的还原剂是______,当1molO2发生反应时,还原剂所失电子的物质的量为______mol。
(3)图为电解精炼银的示意图,______(填a或b)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为 。
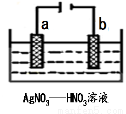
(4)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为 ,其总反应式为: 。
(5)高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g)= 2Fe(s)+3CO2(g)
已知:①FeO(s) + CO(g) = Fe(s) + CO2(g) △H1=-11KJ/mol
②3Fe2O3(s) + CO(g) = 2Fe3O4(s) + CO2(g) △H2=-47KJ/mol
③Fe3O4(s) + CO(g) = 3FeO(s) + CO2(g) △H3=+19KJ/mol
则反应Fe2O3(s) + 3CO(g)= 2Fe(s)+ 3CO2(g)的△H= 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省英文学校高三上学期12月月考化学试卷(解析版) 题型:选择题
下列物质与其用途完全符合的有几条
①Na2CO3-制玻璃 ②SiO2-太阳能电池 ③AgI-人工降雨
④NaCl-制纯碱 ⑤Al2O3-焊接钢轨 ⑥NaClO-消毒剂
⑦MgO-耐火材料 ⑧Fe2O3-红色油漆或涂料
A、4 B、5 C、6 D、7
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省东莞市三校高二上学期期中联考化学试卷(解析版) 题型:填空题
(每空4分,共12分)
(1)已知:TiO2(s)+2Cl2 (g)===TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1
2C(s)+O2(g)===2CO(g) Δ H=-221 kJ·mol-1
写出TiO2和焦炭、氯气反应生成TiCl4和CO气体的热化学方程式: 。
(2)在25℃,101KPa时,CO的燃烧热为280kJ/mol,写出 CO的燃烧热的热化学方程式: 。
(3)在火箭推进器中以肼(N2H4)作为燃料,可以选O2或NO2作为氧化剂,如果以氧气作为氧化剂,其化学反应与能量关系如下,

请写出该反应的热化学方程式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com