
【题目】某样品主要含KCl和少量MgCl2、CaCl2、MgSO4等,需要分离提纯得到KCl。
(1)实验室采用沉淀法测定样品中MgSO4的质量分数。操作步骤如下:
①取10g样品溶于水中,加入足量的BaCl2溶液,充分搅拌反应;②将所得混合物过滤、洗涤。③将沉淀连同滤纸取出放入坩埚中灼烧至恒重(滤纸完全转化成CO2和水,沉淀不分解)④冷却后称量所得沉淀质量为0.466g。
判断沉淀是否洗涤干净的方法是_______________;样品中MgSO4的质量分数为________。
(2)现有几种试剂:①盐酸;②K2CO3;③Na2CO3;④NaOH;⑤KOH;⑥Ba(OH)2;⑦BaCl2;为有效除去样品中的杂质,加入的试剂及顺序合理的是____________,
A.⑦③④ B.⑦⑤② C.②⑥ D.⑤②⑦
过滤除去沉淀后还需要加入的试剂为_________ (填序号),然后进行蒸发结晶。
【答案】取最后一次洗涤液,加入足量硝酸后,滴加AgNO3溶液,没有沉淀生成,证明洗涤干净 2.4% B ①
【解析】
(1)判断沉淀是否洗涤干净就是看沉淀的表面是否含有Cl-;灼烧固体物质一般放在坩埚中进行;根据硫酸根离子守恒进行计算;
(2)为有效除去老卤中的MgCl2、CaCl2 、MgSO4等,可以加入过量KOH (去除镁离子);加入过量BaCl2 (去除硫酸根离子);加入过量K2CO3 (去除钙离子和多余的钡离子)。
(1)判断沉淀是否洗涤干净就是看沉淀的表面是否含有Cl-,其方法为:取最后一次洗涤流出液,加入足量硝酸后,滴加AgNO3溶液,没有沉淀生成,证明洗涤干净;灼烧固体物质一般放在坩埚中进行,所以仪器A的名称为坩埚;根据硫酸根离子守恒,n( MgSO4 ) =n ( BaSO4 ) =![]() =
=![]() =0.002mol,m ( MgSO4 ) =nM=0.002mol×120g/mol=0.24g,则样品中MgSO4的质量分数为
=0.002mol,m ( MgSO4 ) =nM=0.002mol×120g/mol=0.24g,则样品中MgSO4的质量分数为![]() ×100%=2.4%;
×100%=2.4%;
(2)为有效除去老卤中的MgCl2、CaCl2 、MgSO4等,可以加入过量KOH (去除镁离子): Mg2+ +2OH-=Mg(OH)2↓;加入过量BaCl2 (去除硫酸根离子):SO42-+Ba2+=BaSO4↓;加入过量K2CO3 (去除钙离子和多余的钡离子) :Ca2++CO32-=CaCO3↓,碳酸钾必须加在氯化钡之后,氢氧化钾和氯化钡可以颠倒加入的顺序,或直接加入过量的Ba(OH)2 (去除镁离子和硫酸根离子), 再加入加入过量K2CO3 (去除钙离子和多余的钡离子) , 故加入的试剂及顺序合理的是⑦⑤②或⑥②,所以选B;过滤除去沉淀后还需要加入的试剂为盐酸,加适量盐酸,可以少引入杂质,并且盐酸与过量的KOH溶液和过量的K2CO3溶液发生反应,离子方程式为H+ +OH-=H2O、CO32- +2H+ =H2O+CO2↑,从而除掉过量的OH-、CO32- ,故答案为B;①。


科目:高中化学 来源: 题型:
【题目】向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色溶液。
I.在化学实验和科学研究中,水是一种最常用的溶剂。水是生命之源,它与我们的生活密切相关。(1)写出与H2O分子互为等电子体的微粒:_________(填1种)。
(2)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+ )。下列对上述过程的描述不合理的是____(填字母序号)。
A.氧原子的杂化类型发生了改变 B.微粒子的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
II. Cu2+可形成多种配合物,广泛应用于生产生活中。
(3) 实验时将白色粉末无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配离子。请写出该配离子的化学式 :______。向该蓝色溶液中滴加氨水,先形成难溶物,继续加氨水,难溶物溶解,写出溶解过程的离子方程式:________。溶解后得到深蓝色溶液,向溶液加入乙醇,会析出深蓝色晶体,该晶体的化学式为_________ 。
(4)Cu2+可以与乙二胺(H2N﹣CH2CH2﹣NH2)形成配离子(如图)
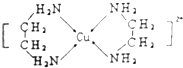
①H、O、N三种元素的电负性从大到小的顺序_______________________.
②乙二胺沸点高于Cl﹣CH2CH2﹣Cl的主要原因是_________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、D、E、F、G为短周期元素,且原子序数依次递增。A、F同主族,E、G同主族。A与其他非金属元素化合时易形成共价键,F与其他非金属元素化合时易形成离子键,且F+离子与E2-核外电子排布相同。由以上元素组成的物质BE和D2具有相同的电子数。请回答以下问题:
(1)F位于元素周期表的位置_______;
(2)G的离子结构示意图为________;
(3)用电子式表示D2的形成过程:_________;
(4)由A、E、F三种元素形成的化合物的化学式为_____,含有的化学键有____(填化学键类型)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示1 g O2与1 g X气体在恒压条件下的密闭容器中体积(V)与温度(T)的关系,则X气体可能是
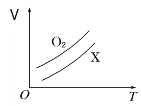
A. C2H4 B. CH4
C. CO2 D. NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列反应曾用于检测司机是否酒后驾驶:2![]() +3CH3CH2OH+16H++13H2O
+3CH3CH2OH+16H++13H2O![]() 4[Cr(H2O)6]3++3CH3COOH
4[Cr(H2O)6]3++3CH3COOH
①配合物[Cr(H2O)6]3+中,与Cr3+形成配位键的原子是___(填元素符号)。
②CH3COOH中C原子轨道杂化类型为___;1 mol CH3COOH分子含有σ键的数目为___。
(2)CS2分子中,C原子的杂化轨道类型是____,写出两个与CS2具有相同空间构型和键合形式的离子____。
(3)石墨烯是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯。
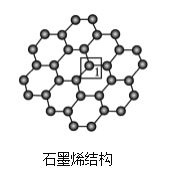
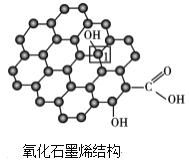
氧化石墨烯中,1号C的杂化方式是____,该C与相邻C形成的C-C键角____(填“>”、“<”或“=”)石墨烯中与1号C相邻C形成的C-C键角。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究减少CO2排放是一项重要课题。CO2经催化加氢可以生成低碳有机物,主要有以下反应:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.6 kJ/mol
CH3OH(g)+H2O(g) △H1=-49.6 kJ/mol
反应Ⅱ:CH3OCH3(g)+H2O(g)![]() 2CH3OH(g) △H2=+23.4 kJ/mol
2CH3OH(g) △H2=+23.4 kJ/mol
反应Ⅲ:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) △H3
CH3OCH3(g)+3H2O(g) △H3
(1)△H3=____kJ/mol。
(2)恒温恒容条件下,在密闭容器中通入等物质的量的CO2和H2,发生反应I。下列描述能说明反应I达到平衡状态的是___(填序号)。
A.反应体系总压强保持不变
B.容器内的混合气体的密度保持不变
C.水分子中断裂2NA个H-O键,同时氢分子中断裂3NA个H-H键
D.CH3OH和H2O的浓度之比保持不变
(3)反应II在某温度下的平衡常数为0.25,此温度下,在密闭容器中加入等物质的量的CH3OCH3(g)和H2O(g),反应到某时刻测得各组分浓度如下:
物质 | CH3OCH3(g) | H2O(g) | CH3OH(g) |
浓度/mol·L-1 | 1.8 | 1.8 | 0.4 |
此时v正___v逆(填“>”、“<”或“=”),当反应达到平衡状态时,混合气体中CH3OH体积分数(CH3OH)% =___%。
(4)在某压强下,反应III在不同温度、不同投料比时,CO2的平衡转化率如图所示。T1温度下,将6mol CO2和12mol H2充入2 L的密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OCH3)=____;KA、KB、KC三者之间的大小关系为____。
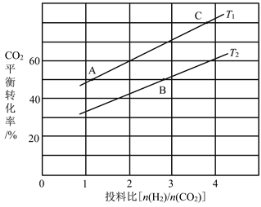
(5)恒压下将CO2和H2按体积比1:3混合,在不同催化剂作用下发生反应I和反应III,在相同的时间段内CH3OH的选择性和产率随温度的变化如图。其中:CH3OH的选择性=![]() ×100%
×100%
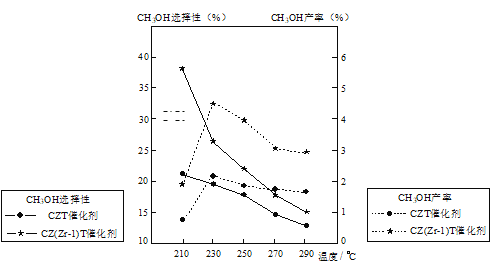
①温度高于230℃,CH3OH产率随温度升高而下降的原因是_____。
②在上述条件下合成甲醇的工业条件是____。
p>A.210℃ B.230℃ C.催化剂CZT D.催化剂CZ(Zr-1)T查看答案和解析>>
科目:高中化学 来源: 题型:
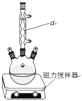
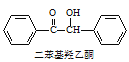
【题目】二苯基乙二酮常用作医药中间体及紫外线固化剂,可由二苯基羟乙酮氧化制得,相关物质的物理参数、化学方程式及装置图(加热和夹持装置已略去)如下:
相对分子质量 | 熔点/℃ | 沸点/℃ | 密度/gcm-3 | 溶解性 | ||
二苯基羟乙酮 | 212 | 133 | 344 | 1.310 | 不溶于冷水,溶于乙醇 | |
二苯基乙二酮 | 210 | 97 | 348 | 1.084 | 不溶于水,能溶于乙醇 |
 +2FeCl3
+2FeCl3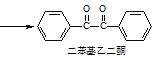 +2FeCl2+2HCl
+2FeCl2+2HCl
在反应装置中,加入10mL冰醋酸、5.50g FeCl3固体、10mL水及少量碎瓷片,加热至沸腾,停止加热,待沸腾平息后加入2.12g二苯基羟乙酮,继续加热回流至二苯基羟乙酮完全反应。反应结束后加水煮沸,冷却后即有二苯基乙二酮粗产品析出,用70%乙醇水溶液重结晶提纯,得到1.80g产品。
重结晶过程如下:
加热溶解→活性炭脱色→趁热过滤→冷却结晶→抽滤→洗涤→干燥
请回答以下问题:
(1)装置图中仪器a的名称是____,其作用是____。
(2)加入碎瓷片的作用是____。若加热后发现未加碎瓷片,应采取的正确方法是___。
(3)实验中可采用薄层色谱跟踪反应进程,其原理和操作与纸上层析类同,通过观察薄层色谱展开后的斑点(在实验条件下,只有二苯基羟乙酮和二苯基乙二酮能够产生斑点)判断样品中的成分。如图分别为加入二苯基羟乙酮后反应开始、回流15min、30min、45min和60min时,用毛细管取样、点样,薄层色谱展开后的斑点:

该实验条件下加热____后可认为反应结束。
A.15min B.30min C.45min D.60min
(4)上述重结晶过程中,____(填步骤名称)操作除去了不溶性杂质。
(5)在重结晶过程中,不可选用明火直接加热,原因是____。
(6)不选择蒸馏的方法提纯二苯基乙二酮粗产品的原因是_____。
(7)本实验的产率是____%。(保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 将含1molFeCl3的溶液滴入沸水中,所制得的Fe(OH)3胶体粒子为NA
B. 常温常压下,1 mol甲基(-CH3)所含电子数为10NA
C. 常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA
D. 标准状况下,11.2L三氯甲烷中含有的极性共价键数目为1.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有下列状态的物质:①干冰 ②NaHCO3晶体 ③氨水 ④纯醋酸 ⑤FeCl3溶液 ⑥铜 ⑦熔融KOH。其中能导电的是___,(填序号,下同),属于电解质的是___,属于非电解质的是___。
(2)将3p%的硫酸与同体积的p%的硫酸混合得到q%的稀硫酸,则q___2p(填“大于”、“小于”、或“等于”)。
(3)在同温、同压下,实验测得CO、N2和SO2三种气体的混合气体的密度是H2的20倍,其中SO2的体积分数为____%(小数点后保留一位数字);若其中CO和N2的物质的量之比为1∶1,则混合气体中氧元素的质量分数为____%。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com