
����Ŀ���ڲ��������У���¯��ԭ�Ϸ�������Ҫ��ӦΪ��2Na2CO3+CaCO3+3SiO2![]() 2Na2SiO3+CaSiO3+3CO2����
2Na2SiO3+CaSiO3+3CO2����
(1)ij��Ӧ��������״̬�²����磬������______���塣
(2)������Ӧ�����漰�Ķ�����Ԫ��ԭ�Ӱ뾶�ɴ�С��˳��Ϊ________��
(3)̼������ͬ��Ԫ�أ�����Ԫ�ص�ԭ���������ӵļ۲���ӱ�ʾʽΪ________��
(4)дһ���ܱȽ�̼Ԫ�غ���Ԫ�طǽ�����ǿ���Ļ�ѧ��Ӧ����ʽ��________��
(5)CO2�ĵ���ʽΪ_______��
(6)��Ӧ��Na2CO3��CaCO3�����Ʊ�������̼�������������Ƕ���ʹ��ϡ���ᣬ��˵�����ɡ�______
���𰸡�ԭ�� Na>Si>C>O ns2np2 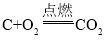
![]() CaCO3��ϡ���ᷴӦ���ɵ�CaSO4����ˮ���ḽ����CaCO3������ֹ��Ӧ��һ������
CaCO3��ϡ���ᷴӦ���ɵ�CaSO4����ˮ���ḽ����CaCO3������ֹ��Ӧ��һ������
��������
(1)��Ӧ����Na2CO3��CaCO3Ϊ���Ӿ��壬SiO2Ϊԭ�Ӿ��壻
(2)��Ӧ���漰Na��C��Si��O��Ca����Ԫ�أ����������������е�λ�ü�Ԫ�������ɷ�����
(3)C��Siλ�ڵ�IVA���������4�����ӣ����ݺ�������Ų�������д��
(4)���ݶ����γɻ�������Ԫ�ػ��ϼ۵������жϣ�
(5)Cԭ����2��Oԭ���γ�4�����õ��Ӷԣ�
(6)���ݷ�Ӧ������ܽ��ԡ���Ӧ���еĿ���������
(1)��Ӧ����Na2CO3��CaCO3���Σ��������Ӿ��壬���Ӿ���������״̬ʱ������������ƶ������ӣ�����ܵ��磬��SiO2Ϊԭ�Ӿ��壬ԭ��֮��ͨ�����ۼ�����γɾ��壬ԭ�Ӿ���������״̬�²����磻
(2)��������Ӧ���漰Na��C��Si��O��Ca����Ԫ�أ�Caλ�ڵ������ڣ�Na��Siλ�ڵ������ڣ�C��Oλ�ڵڶ����ڣ�����ͬһ���ڵ�Ԫ�أ�ԭ������Խ��ԭ�Ӱ뾶ԽС����ͬ���ڵ�Ԫ�أ�ԭ�Ӻ�����Ӳ���Խ�࣬ԭ�Ӱ뾶Խ������������Ӧ�����漰�Ķ�����Ԫ��ԭ�Ӱ뾶�ɴ�С��˳��ΪNa>Si>C>O��
(3)̼������ͬһ��Ԫ�أ�����Ԫ�ص�ԭ������������Ϊ4�������ݺ�������Ų����ɿɵø���Ԫ�صļ۲�����Ų�ʽΪns2np2��
(4)C��O2�ڵ�ȼ�����·�����Ӧ����CO2���壬�ڸ÷�Ӧ������CO2�У�CΪ+4�ۣ�OΪ-2�ۣ�����O������������ǿ�����õ��Ӷ�ƫСOԭ�ӣ�ƫ��Cԭ�ӣ��Ӷ�֤��Ԫ�صķǽ�����O>C��
(5)��CO2�����У�Cԭ����2��Oԭ���γ�4�����õ��Ӷԣ��Ӷ�ʹ������ÿ��ԭ�Ӷ��ﵽ8�����ӵ��ȶ��ṹ������ʽΪ![]() ��
��
(6)�������Ͽ�֪��Ӧ��Na2CO3��CaCO3�����Ʊ�������̼�������������Ƕ���ʹ��ϡ���ᣬNa2CO3�����ᷴӦ����Na2SO4���п����ԣ��Է�Ӧ��Ӱ�죬��CaCO3��ϡ���ᷴӦ���ɵ�CaSO4����ˮ���ḽ����CaCO3������ֹ��Ӧ��һ�����У���˾Ͳ���ʹ��H2SO4�Ʊ�CO2��


 �ִʾ��ƪϵ�д�
�ִʾ��ƪϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���Ľṹ��ʽ��ͼ��ʾ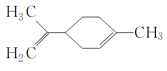 �������йظ��л����˵����ȷ����(����)
�������йظ��л����˵����ȷ����(����)
A.���л���Ļ�ѧʽΪC10H14
B.����һ�ȴ�����6��
C.���л�����������е�̼ԭ��һ����ͬһƽ����
D.һ�������£������Է���ȡ�����ӳɡ������ͻ�ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���Ľṹ��ʽΪ ��������ṹ�����ش��������⣺
��������ṹ�����ش��������⣺
(1)д�������ʽ��____________________________________________��
(2)���к���____��������̼ԭ�ӣ���������____��˫����
(3)�����еļ��Լ���__________(д��2�ּ���)��
(4)�����еı���̼ԭ����______����һ���뱽������ͬһƽ���̼ԭ����______����
(5)������C��C===O����ԼΪ__________��H��C��C����ԼΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£�10mL 0.40 mol��L-1H2O2��Һ�������ֽ⡣��ͬʱ�̲������O2�������������Ϊ��״�������±���
t/min | 0 | 2 | 3 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
������������ȷ���ǣ� ������Һ����仯���Բ��ƣ�
A. ��Ӧ��6minʱ��H2O2�ֽ���50��
B. ��Ӧ��6minʱ��c(H2O2)=0.20 mol��L-1
C. 0~6min��ƽ����Ӧ���ʣ�v(H2O2)��3.3��10-2mol/(L��min)
D. 4~6min��ƽ����Ӧ���ʣ�v(H2O2)>3.3��10-2mol/(L��min)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
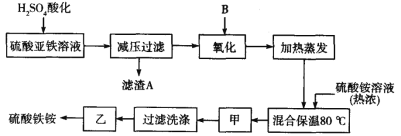
����Ŀ���������[aFe2(SO4)3��b(NH4)2SO4��cH2O]�㷺���ڳ�����������ˮ����ҵѭ��ˮ�ľ��������ȡ�ij����������������������������ƣ��������Ϊԭ�ϣ���������¹���������ȡ������李�
��ش��������⣺
(1)����������Һ�� H2SO4 �ữ����ҪĿ����____________������ A����Ҫ�ɷ���______________��
(2)�������������ʺϵ������� B ��____________��
a��NaClO b��H2O2 c��KMnO4 d��K2Cr2O7
(3)�����ס��ҵ����Ʒֱ��ǣ���_____________����_____________��
(4)���������У���һ�������ܣ���ָ������_____________��
(5)�������������NH4+�ķ�����_____________��
(6)��ȡ 14.00 g ��Ʒ����������ˮ���Ƴ� 100 mL ��Һ�����ֳ����ȷݣ�������һ�� �м������� NaOH ��Һ������ϴ�ӵõ� 2.14 g ����������һ����Һ�м��� 0.05 mol Ba(NO3)2 ��Һ��ǡ����ȫ��Ӧ�����������淋Ļ�ѧʽΪ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������H2O2�ڷ�Ӧʱ��������Ⱦ�����Ϊ��ɫ������������ܵ�����Խ��Խ��Ĺ�ע��
��. ijʵ��С����H2O2�ֽ�Ϊ����̽��Ũ�ȡ���������Һ����ԶԷ�Ӧ���ʵ�Ӱ�졣�ڳ����°����±���ʾ�ķ������ʵ�顣
ʵ���� | ��Ӧ�� | ���� |
�� | 10 mL 2% H2O2��Һ | �� |
�� | 10 mL 5% H2O2��Һ | �� |
�� | 10 mL 5% H2O2��Һ+1 mL H2O | 1 mL 0.1 mol��L-1FeCl3��Һ |
�� | 10 mL 5% H2O2��Һ+1 mL HCl��Һ | 1 mL 0.1 mol��L-1FeCl3��Һ |
�� | 10 mL 5% H2O2��Һ+1 mL NaOH��Һ | 1 mL 0.1 mol��L-1FeCl3��Һ |
��1��ʵ��ٺ͢ڵ�Ŀ����___��ͬѧ�ǽ���ʵ��ʱû�й۲쵽������������ó����ۡ�������ʾ��ͨ��������H2O2�ȶ������ֽ⡣Ϊ�˴ﵽʵ��Ŀ�ģ����ԭʵ�鷽���ĸĽ�������__________(д��һ�ּ���)��
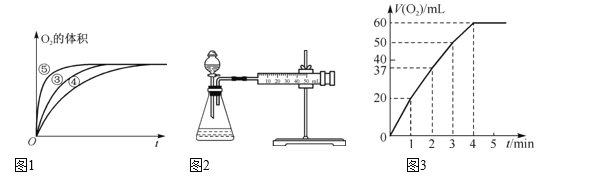
��2��ʵ��ۡ��ܡ����У�������������������ʱ��仯��ͼ1��ʾ��������ͼ�ܹ��ó���ʵ�������____��
��. MnO2��H2O2�ķֽ��д����ã�ijʵ��С���H2O2�ķֽ���������̽�����±��Ǹ�ʵ��С���о�Ӱ��H2O2�ֽ����ʵ�����ʱ��¼��һ�����ݣ���״̬��ͬ��0.1 g MnO2�ֱ����ʢ��50 mL��Ũ�ȵ�H2O2��Һ�Ĵ��Թ��У����ô����ǵ�ľ�����ԣ�������£�
MnO2״̬ | �����Թ���� | �۲��� | ��Ӧ�������ʱ�� |
��ĩ״ | ���� | ���ҷ�Ӧ�������ǵ�ľ����ȼ | 4 min |
��״ | �� | ��Ӧ���������Ǻ�����ľ��δ��ȼ | 30 min |
��1��д�����Թ��з�����Ӧ�Ļ�ѧ����ʽ��__���÷�Ӧ��____��Ӧ(��������������������)��
��2��ʵ���������������Ĵ�Ч����____�йء�
��3��ʵ������зų���������(��״��)��ʱ��Ĺ�ϵ��ͼ3��ʾ�����ͷ�Ӧ���ʱ仯��ԭ��__������H2O2�ij�ʼ���ʵ���Ũ��Ϊ____��(������λ��Ч����)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2019����ʷ�������֯��ȫ��̼�ƻ���12��4�շ������棺�о���ʾ��ȫ�������̼�ŷ��������� ����CO2���ۺ������ǽ�������������Ч;����
��1��һ��;���ǽ�CO2ת�����л���ʵ��̼ѭ�����磺
![]()
![]()
![]() ��H3=____
��H3=____
��2��CO2���黯��Ӧ���ɷ�����ѧ��Paul Sabatier����ģ���ˣ��÷�Ӧ�ֽ�Sabatier��Ӧ��CO2���⻯ �Ƽ�����о��������£�
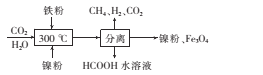
�����������У�����H2��Ӧ�Ļ�ѧ����ʽΪ____
��HCOOH��CO2ת��ΪCH4���м��壺CO2![]() HCOOH
HCOOH![]() CH4����������������10������IJ���Ѹ�ټ��٣���������������ʱ��CO2�����⻯�Ƽ����������Ӧ�з�Ӧ�������ӽϴ��һ����_____����I������������
CH4����������������10������IJ���Ѹ�ټ��٣���������������ʱ��CO2�����⻯�Ƽ����������Ӧ�з�Ӧ�������ӽϴ��һ����_____����I������������
��3��CO2��������������ɵ�̼������Ҫ������������Ӧ��
��ӦI: ![]()
��Ӧ����![]()
��1 L�����ܱ������г���1 mol CO2��4 mol H2�����ƽ��ʱ�й����ʵ����ʵ������¶ȱ仯��ͼ��ʾ��T1��ʱ��CO2��ת����Ϊ____��T1��ʱ����ӦI��ƽ�ⳣ��K= ___��
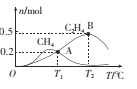
��4����֪CO2������ϳ��Ҵ��ķ�Ӧԭ��Ϊ![]() ��m������ʼʱ��Ͷ�ϱȣ���
��m������ʼʱ��Ͷ�ϱȣ���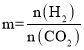
��ͼ1��Ͷ�ϱ���ͬ���¶�T3>T2>T1�����H ______������>������<����0��
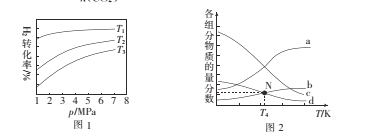
��m=3ʱ���÷�Ӧ�ﵽƽ��״̬��p���ܣ�=20a MPa����ѹ�����¸����ʵ����ʵ����������¶ȵĹ�ϵ��ͼ2��������b����������Ϊ ___���ѧʽ����T4�¶�ʱ����Ӧ�ﵽƽ��ʱ����d�ķ�ѹp��d��=______
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��5������������������Ҫ���л��ϳ��м��壬��������Ȼ���ʰ������صĺϳɣ�һ���Լ䱽����Ϊԭ�ϵĺϳɷ�Ӧ���£�

�״������Ѻ�3��5�������������ӵIJ����������ʼ��±���
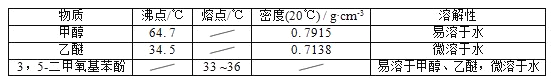
��1����Ӧ�������ȷ�����״����ټ������ѽ�����ȡ���ٷ�����״��IJ����ǵ�______������ȡ�õ��ķ�Һ©��ʹ��ǰ��__________________��ϴ������Һʱ�л����ڷ�Һ©����________����ϡ����¡����㣻
��2������õ����л��������ñ���NaHCO3��Һ������ʳ��ˮ����������ˮ����ϴ�ӣ��ñ���NaHCO3��Һϴ�ӵ�Ŀ����__���ñ���ʳ��ˮϴ�ӵ�Ŀ����______��
��3��ϴ����ɺ�ͨ�����²������롢�ᴿ�����ȷ�IJ���˳����__������ĸ����
a�������ȥ���� b���ؽᾧ c�����˳�ȥ����� d��������ˮCaCl2����
��4����Һ���볣���ü�ѹ���ˣ�Ϊ�˷�ֹ��������ѹ������ɺ�Ӧ��________________����______��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com