
| A. | x的原子半径大于y的原子半径 | |
| B. | x的第一电离能小于y 的第一电离能 | |
| C. | x的金属性大于y的金属性 | |
| D. | x的电负性大于y的电负性 |
分析 x元素的阴离子和y元素的阳离子具有相同的电子层结构,离子核外电子数目相等,则y元素处于x元素的下一周期,x为非金属元素,最外层电子数较多,y为金属元素,最外层电子数相对较少,结合元素周期律解答.
解答 解:x元素的阴离子和y元素的阳离子具有相同的电子层结构,离子核外电子数目相等,则y元素处于x元素的下一周期,x为非金属元素,最外层电子数较多,y为金属元素,最外层电子数相对较少.
A.y元素处于x元素的下一周期,x为非金属元素,原子半径小于同周期与y处于同族的元素,故原子半径y>x,故A错误;
B.x为非金属元素,y为金属元素,故x的第一电离能大于y的第一电离能,故B错误;
C.x为非金属元素,y为金属元素,故x的金属性弱于y的金属性,故C错误;
D.x为非金属元素,y为金属元素,故x的电负性高于y的电负性,故D正确;
故选D.
点评 考查结构与位置的关系、半径与电负性、第一电离能比较等,难度不大,关键根据离子具有相同的电子层结构推断元素的相对位置,注意对元素周期律的理解掌握.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 96% | B. | 48% | C. | 9.6% | D. | 56% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{17}^{37}$Cl2的摩尔质量是74 | |
| B. | ${\;}_{17}^{37}$Cl、${\;}_{17}^{35}$Cl互为同位素,${\;}_{17}^{35}$Cl2与Cl2互为同分异构体 | |
| C. | 通常情况下,氯气做氧化剂,但氯气也具有还原性 | |
| D. | 能使湿润的淀粉KI试纸变蓝色的物质一定是Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往新配制的可溶性淀粉溶液中滴加碘水,溶液显蓝色,用CCl4不能从中萃取出碘 | |
| B. | 硝酸钾饱和溶液冷却未出现结晶时,可以用玻棒充分磨擦器皿壁促使晶体析出 | |
| C. | 制备硫酸亚铁铵晶体时,最后在蒸发皿中蒸发浓缩溶液时,只需小火加热至溶液表面出现晶膜为止,不能将溶液全部蒸干 | |
| D. | 重结晶时,溶液冷却速度越慢得到的晶体颗粒越小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙炔是有机合成工业的一种原料.工业上曾用CaC2与水反应生成乙炔.
乙炔是有机合成工业的一种原料.工业上曾用CaC2与水反应生成乙炔. ;1mol O22+中含有的π键数目为2NA个.
;1mol O22+中含有的π键数目为2NA个.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+、H+、Na+、NO3- | B. | SiO32-、K+、Br-、H+ | ||
| C. | NH4+、Cl-、Mg2+、SO42- | D. | Na+、OH-、NH4+、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. →
→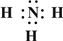 ,B的结构式
,B的结构式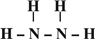
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com