
| A. | pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5mol•L-1 | |
| B. | pH相同的①CH3COONa ②NaHCO3 ③NaClO三种溶液的c(Na+):①>②>③ | |
| C. | pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)═c(OH-)+c(HC2O4-) | |
| D. | pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 |
分析 A.c(H+)=10-pH,任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
B.pH相同的钠盐,弱酸根离子水解程度越大其相应浓度越小;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
D.一水合氨是弱电解质,加水稀释促进其电离.
解答 解:A.c(H+)=10-pH,任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(H+)=c(HS-)+2c(S2-)+c(OH-)=1×10-5mol•L-1,故A错误;
B.pH相同的钠盐,弱酸根离子水解程度越大其相应浓度越小,弱酸根水解程度:ClO->HCO3->CH3COO-,所以钠盐浓度 ①>②>③,根据Na原子守恒知三种溶液的c(Na+):①>②>③,故B正确;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)═c(OH-)+c(HC2O4-)+2c(C2O42-),故C错误;
D.一水合氨是弱电解质,加水稀释促进其电离,但一水合氨电离增大程度小于溶液体积增大程度,所以溶液中c(OH-)降低,溶液的pH减小,稀释后溶液pH存在a<b+1,故D错误;
故选B.
点评 本题考查离子浓度大小比较,为高频考点,明确溶液中溶质及其性质是解本题关键,注意任何电解质溶液中都存在电荷守恒和物料守恒,易错选项是D,稀释10倍时溶液pH减小小于1.


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
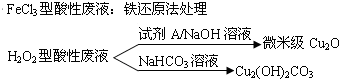
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
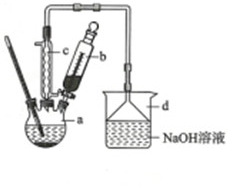
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
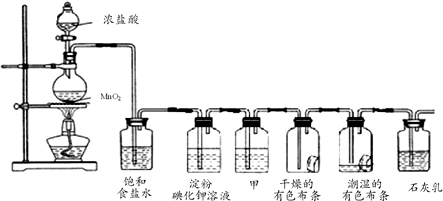
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ③④ | C. | ②④⑤ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:l | B. | 1:2 | C. | 3:2 | D. | 2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | .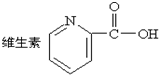 中的含氧官能团的名称是:羧基 中的含氧官能团的名称是:羧基 | |
| B. | 分子式为C4H8的烃中一定含有官能团碳碳双键 | |
| C. | 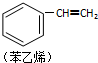 1 mol苯乙烯(如图)中含有的C═C键数为4NA(NA为阿伏加德罗常数) 1 mol苯乙烯(如图)中含有的C═C键数为4NA(NA为阿伏加德罗常数) | |
| D. | 丙烯的结构简式可以表示为:CH3CHCH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com