
现有下列五种物质:
A 食盐 B 食醋 C 苹果汁 D 葡萄糖 E 青霉素
请按下列要求填空(填序号,每空只填一个):
富含维生素C的是 ;可直接进入血液,补充能量的是 ;应用最广泛的抗生素之一的是 ;既可作为食品酸味调味剂,又可作为防腐剂的是 ;食用过多会引起血压升高、肾脏受损的 。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2015-2016学年河北省高二下期中化学试卷(解析版) 题型:实验题
某同学用右图所示实验装置制取乙酸乙酯。回答以下问题:(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)

(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入几块碎瓷片,其目的是______。
(2)在烧瓶中加入一定比例的乙醇和浓硫酸的混合液的方法是:
(3)在该实验中,若用1mol乙醇和1mol 乙酸在浓硫酸作用下加热,充分反应,能否生成1mol乙酸乙酯? ,原因是 。
(4)与书中采用的实验装置的不同之处是:这位同学采用了球形干燥管代替了长导管,并将干燥管的末端插入了饱和碳酸钠溶液中,在此处球形干燥管的作用有:① ,② 。
(5)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法。
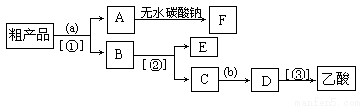
①试剂a是________,试剂b是_______;分离方法①是_______,分离方法③是______。
②在得到的A中加入无水碳酸钠粉末,振荡,目的是_ __。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省、永年二中高一下学期期中化学试卷(解析版) 题型:选择题
X与X+的两种微粒,下列叙述正确的是( )
A.一定都是由质子、中子、电子组成的
B.化学性质几乎完全相同
C.质子数一定相同,质量数和中子数一定不相同
D.核电荷数和核外电子数一定相等
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省周口市高一下学期期中考试化学试卷(解析版) 题型:选择题
NH3和O2在一定条件下发生反应:4NH3(g)+3O2(g) 2N2(g)+6H2O(g),现向一容积不变的2 L密闭容器中充入4 mol NH3和3 mol O2,4 min后反应达到平衡,测得生成的H2O占混合气体总体积的40%,则下列表示此段时间内该反应的平均速率不正确的是
2N2(g)+6H2O(g),现向一容积不变的2 L密闭容器中充入4 mol NH3和3 mol O2,4 min后反应达到平衡,测得生成的H2O占混合气体总体积的40%,则下列表示此段时间内该反应的平均速率不正确的是
A.v(N2)=0.125 mol·L-1·min-1 B.v(H2O)=0.375 mol·L-1·min-1
C.v(O2)=0.225 mol·L-1·min-1 D.v(NH3)=0.250 mol·L-1·min-1
A.①② B.③④ C.①④ D.②③
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省周口市高一下学期期中考试化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.化学反应一定只伴随热量的变化
B.凡是吸热或放热过程中热量的变化均称为反应热
C.若△H<0,则反应物的能量高于生成物的能量
D.若△H>0,则反应物的能量高于生成物的能量
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽黄山屯溪一中高二下期中文科化学试卷(解析版) 题型:选择题
区分羊毛织品和尼龙布最简单有效的方法是
A.灼烧并闻气味 B.观察外观
C.放在水中比较柔软性 D.取样品,请专业机构分析鉴定
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽黄山屯溪一中高二下期中文科化学试卷(解析版) 题型:选择题
某工厂的废渣中混有少量的锌粉和氧化铜(其它成分不跟酸反应),跟废盐酸接触形成污水。若向该污水中撒入铁粉,反应后铁粉有剩余,所得溶液中一定含有的金属离子是
A.Fe2+、Cu2+ B.Cu2+、Zn2+ C.Zn2+、Fe2+ D.Zn2+、Fe3+
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三第三次模拟理综化学试卷(解析版) 题型:选择题
设NA代表阿伏加德罗常数的数值,下列说法中正确的是( )
A.1mol NaHSO4晶体含有2NA个离子
B.1L2mol/L明矾溶液经水解可得到氢氧化铝胶体粒子的数目为2NA个
C.1mol CH3+(碳正离子)中含有的电子数为10NA
D.在O2参与的反应中,1molO2 作氧化剂时得到的电子数一定是4NA
查看答案和解析>>
科目:高中化学 来源:2016届湖南省等四校高三联考化学试卷(解析版) 题型:填空题
I.为有效控制雾霾,各地积极采取措施改善大气质量。有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要。在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质。热化学反应方程式为 2NO(g)+2CO(g) N2(g)+2CO2(g) △=-746.5kJ• mol-1,将1.0 mol NO和1.0 mol CO充入一个容积为10L的密闭容器中,反应过程中物质浓度变化如图所示。
N2(g)+2CO2(g) △=-746.5kJ• mol-1,将1.0 mol NO和1.0 mol CO充入一个容积为10L的密闭容器中,反应过程中物质浓度变化如图所示。
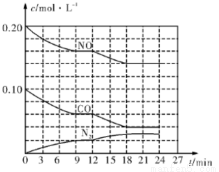
(1)CO在0〜9 min内的平均反应速率w(CO)= mol • L-1•min-1(保留两位有效数字);第12 min时改变的反应条件可能为 。
A.升高温度 B.减小压强 C.降低温度 D.加催化剂
(2)该反应在第24 min时已达到平衡状态,此时C02的体积分数为 (数值保留至小数点后一位),化学平衡常数K= (数值保留至小数点后一位)。
Ⅱ.能源的开发利用与人类社会的可持续发展息息相关。
(1)已知:Fe2O3(s)+3C(s) 2Fe(s)+3CO(g) △H1=a kJ • mol-1
2Fe(s)+3CO(g) △H1=a kJ • mol-1
CO(g) +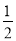 O2 (g)
O2 (g) CO2 (g) △H2=ckJ• mol-1
CO2 (g) △H2=ckJ• mol-1
4Fe(s)+3O2(g) 2Fe2O3 (s) △H3=c kJ • mol-1
2Fe2O3 (s) △H3=c kJ • mol-1
则C的燃烧热△H=________kJ•mol-1。
(2)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是 (填序号)。
A.C(s )+CO2 (g)=2CO(g)
B.NaOH(aq) + HCl(aq)=NaCl(aq) +H2O(l)
C.2CO(g) +O2(g)=2CO2 (g )
D.2H2O(1 )=2H2(g)+O2(g )
(3 )若以熔融的K2CO3与CO2为反应的环境,依据所选反应设计成一个原电池, 请写出该原电池的负极反应: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com