
【题目】常温下,用 0.1000 mol·L-1 NaOH溶液滴定 20.00 mL 0.1000 mol·L-1 CH3COOH溶液,所得溶液的pH随加入NaOH溶液的体积变化如下图。下列说法正确的是

A.V(NaOH)=5 mL:c(Na+)=c(CH3COO-)
B.V(NaOH)=10 mL:c(Na+)<c(CH3COO-)
C.pH=7:c(Na+)>c(CH3COOH)+c(CH3COO-)
D.V(NaOH)=15 mL:3c(CH3COOH)+4c(H+)=c(CH3COO-)+4c(OH-)
【答案】BD
【解析】
A. 当V(NaOH)=5 mL时,溶液呈酸性,根据电荷守恒判断离子浓度大小关系;
B. 当V(NaOH)=10 mL时,溶液呈酸性,根据电荷守恒判断离子浓度大小关系;
C. 常温下,当溶液pH=7时,消耗的NaOH溶液的体积小于20.00ml;
D. 当V(NaOH)=15 ml时,根据物料守恒和电荷守恒进行计算。
A. 当V(NaOH)=5 mL时,n(NaOH)=0.1000mol/L×5×10-3L=5×10-4 mol,n(CH3COOH)= 0.1000mol/L×0.02L=0.002 mol,n(CH3COOH)> n(NaOH),溶液呈酸性,根据电荷守恒可知,c(Na+)+ c(H+)= c(CH3COO-)+ c(OH-),由于溶液呈酸性,c(H+)> c(OH-),那么c(Na+)<c(CH3COO-),A项错误;
B. 当V(NaOH)=10 mL时,n(NaOH)=0.1000mol/L×10×10-3L=0.001 mol,n(CH3COOH)= 0.1000mol/L×0.02L=0.002 mol,n(CH3COOH)> n(NaOH),溶液呈酸性,根据电荷守恒可知,c(Na+)+ c(H+)= c(CH3COO-)+ c(OH-),由于溶液呈酸性,c(H+)> c(OH-),那么c(Na+)<c(CH3COO-),B项正确;
C. 消耗NaOH溶液的体积为20.00ml时,醋酸和氢氧化钠恰好完全反应,溶液中醋酸根离子水解,使溶液显碱性,因此当溶液pH=7时,消耗的NaOH溶液的体积小于20.00ml,则c(Na+)<c(CH3COOH)+c(CH3COO-),C项错误;
D. 当V(NaOH)=15 ml时,根据电荷守恒可知,c(Na+)+ c(H+)= c(CH3COO-)+ c(OH-),即c(Na+)=c(CH3COO-)+c(OH-)-c(H+),根据物料守恒可知,4c(Na+)=3c(CH3COO-)+3 c(CH3COOH),将c(Na+)带入后可得3c(CH3COOH)+4c(H+)=c(CH3COO-)+4c(OH-),D项正确;
答案选BD。


科目:高中化学 来源: 题型:
【题目】钛化合物常见价态有+2和+4。钛白粉(TiO2,两性氧化物)用途广泛。工业上由高钛渣(主要成分为Ti3O5,还含有TiO2、Fe2O3等)制取钛白粉的主要工艺过程如下:
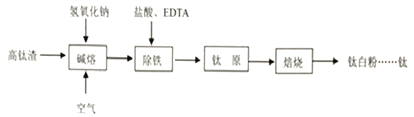
(1)写出碱熔步骤所发生反应的化学方程式____________、____________。
(2)实验测定EDTA加入量(EDTA和Fe3+的物质的量之比)对 Ti4+和Fe3+溶出率的影响如图所示。由图可知,EDTA的加入量为____________时除铁效率最佳,理由是____________。

(3)在实验室模拟除铁净化后的实验步骤:①向钛原料中加入稀硫酸生成偏钛酸(H2TiO3)沉淀,反应结束后过滤;②洗涤;③……;④在650℃下高温焙烧得到较纯的钛白粉固体。步骤③的实验目的是____________,需要用到的试剂有____________。
(4)测定钛白粉纯度:称取试样0.200g在CO2气氛下用金属铝将钛(IV)还原成钛(Ⅲ),还原后的溶液以NH4SCN为指示剂,用0.08mol/L的 NH4Fe(SO4)2标准液滴定,滴定终点时消耗标准液29.20mL,钛白粉的纯度为____________。(保留三位有效数字)
(5)最新研究发现也可以用图示装置由TiO2获得金属钛。装置中阳极的电极反应方程式为____________,在制备金属钛前后,整套装置中CaO的总量____________(填写“增大”、“减小”或者“不变”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于说法正确的是
A. HCl和NaOH反应的中和热为57.3kJ/mol,H2SO4和Ba(OH)2反应的中和热也为57.3kJ/mol
B. 已知C2H5OH(l)的燃烧热是1366.8kUmol,则C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g)反应的△H=-1366.8kJ/mol
C. 一定温度和压强下,将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放出热量19.3kJ.则其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6 kJ/mol
2NH3(g) △H=-38.6 kJ/mol
D. 一定条件下2SO2(g)+O2(g)![]() 2SO3(g)△H1 2SO2(g)+O2(g)
2SO3(g)△H1 2SO2(g)+O2(g)![]() 2SO3(l)△H2则△H1>△H2
2SO3(l)△H2则△H1>△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气与碱溶液反应,在低温和稀碱溶液中主要产物是ClO-和Cl-,在75℃以上和浓碱溶液中主要产物是ClO3-和Cl-,研究小组用如图实验装置制取氯酸钾(KClO3),并测定其纯度。
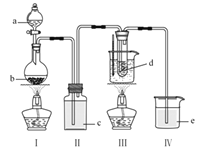
a为浓盐酸 b为MnO2 c为饱和食盐水 d为30%KOH溶液 e为NaOH溶液
回答下列问题:
(1)检查装置气密性后,添加药品,待装置Ⅲ水温升至![]() 开始反应。
开始反应。
①写出装置Ⅰ中反应的化学方程式为______。
②若取消装置Ⅱ,对本实验的影响是______。
③实验结束,拆解装置Ⅰ前为了防止大量氯气逸出,可采取的措施是______。
④从装置Ⅲ的试管中分离得到KClO3粗产品,其中混有的杂质是KClO和______。
(2)已知碱性条件下,ClO-有强氧化性,而ClO3-氧化性很弱。设计实验证明:碱性条件下,H2O2能被ClO-氧化,而不能被ClO3-氧化。______。
(3)为测定产品KClO3的纯度,进行如下实验:
步骤1:取2.45 g样品溶于水配成250 mL溶液。
步骤2:取25.00 mL溶液于锥形瓶中,调至pH=10,滴加足量H2O2溶液充分振荡,然后煮沸溶液1~2分钟,冷却。
步骤3:加入过量KI溶液,再逐滴加入足量稀硫酸。(ClO3-+6I-+6H+=Cl-+3I2+3H2O)
步骤4:加入指示剂,用0.5000 mol/LNa2S2O3标准溶液滴定至终点,消耗标准溶液20.00 mL(2S2O32-+I2=S4O62-+2I-)
![]() 步骤2的目的是______。写出煮沸时反应的化学方程式______。
步骤2的目的是______。写出煮沸时反应的化学方程式______。
![]() 样品中KClO3的质量分数为______。(KClO3相对分子质量:122.5)
样品中KClO3的质量分数为______。(KClO3相对分子质量:122.5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可溶性钡盐有毒,医院中常用硫酸钡这种钡盐作为内服造影剂。医院抢救钡离子中毒患者时,除催吐外,还需要向中毒者胃中灌入硫酸钠溶液。已知:Ksp(BaCO3)=5.1×10-9 mol2·L-2;Ksp(BaSO4)=1.1×10-10 mol2·L-2。下列推断正确的是( )
A. 不用碳酸钡作为内服造影剂,是因为Ksp(BaCO3)>Ksp(BaSO4)
B. 抢救钡离子中毒患者时,若没有硫酸钠,可以用碳酸钠溶液代替
C. 若误饮[Ba2+]=1.0×10-5 mol·L-1的溶液时,会引起钡离子中毒
D. 可以用0.36 mol·L-1的Na2SO4溶液给钡离子中毒患者洗胃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 常温下,向20 mL 0.01mol/L CH3COOH溶液中逐滴加入0.01mol/L 的NaOH溶液,溶液中水所电离出的c(H+)随加入NaOH溶液的体积变化示意图如图所示,下列说法不正确的是

A.从a到c,醋酸的电离始终受到促进
B.a、d对应的纵坐标数值分别是:>10-12、>10-7
C.b点:2c(Na+)=c(CH3COO-)+c(CH3COOH)
D.从b→c的过程中,既存在着pH=7的点,也存在着溶液中水所电离出的c(H+)=10-7的点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法错误的是
A.标准状况下,以任意比混合的氢气和一氧化碳气体共8.96L,在足量氧气中充分燃烧时消耗氧气的分子数为0.2NA
B.用惰性电极电解硫酸铜溶液时,若溶液的pH值变为1时,则电极上转移的电子数目为NA
C.32.5 g锌与一定量浓硫酸恰好完全反应,生成气体的分子数为0.5NA
D.反应3H2(g)+N2(g)![]() 2NH3(g) ΔH=-92 kJ·mol-1,当放出热量9.2 kJ时转移电子0.6NA
2NH3(g) ΔH=-92 kJ·mol-1,当放出热量9.2 kJ时转移电子0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究碘单质在相关反应中的转化和生成具有重要价值。
(1)TaS2晶体是一种强关联二维材料,在一定条件下可发生如下反应:
TaS2(s)+2I2(g) ![]() TaI4(g)+S2(g) ΔH>0
TaI4(g)+S2(g) ΔH>0
①T℃时,向体积为2 L恒容密闭容器中加入0.3 mol I2(g)和0.3 mol TaS2(s),达到平衡时,I2(g)的物质的量为0.1 mol。该反应的平衡常数为__________。向平衡后的容器中再充入0.3 mol I2(g),下列说法正确的是__________(填字母)。
A.当2v(I2)正=v(S2)逆时,反应到达新的平衡
B.当混合气体的颜色不再发生变化时,反应到达新的平衡
C.反应达到新平衡时,压强与原平衡相同
D.反应达到新平衡时,混合气体的密度是原平衡的两倍
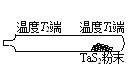
②利用“化学蒸气转移法”可以提纯含难挥发杂质的TaS2粉末。反应在如右图所示的石英真空管中进行。先在温度为T1 的一段放入未提纯的TaS2粉末,充入少量I2(g),一段时间后,在温度为T2 一端得到了纯净TaS2晶体。则温度T1__________T2(填“>”“<”或“=” )。
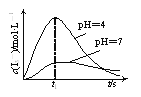
(2)某实验小组对其他条件一定,不同pH时O3持续通入NaI溶液中的过程和结果进行了研究。O3通入NaI溶液中的反应过程如下,I3-的浓度随时间的变化如下图所示。
反应1:I(aq)+O3(g)=IO(aq)+O2(g)
反应2:IO(aq)+2H+(aq)+I(aq) ![]() I2(aq)+H2O(l)
I2(aq)+H2O(l)
反应3:I2(aq)+I(aq) ![]() I3(aq)
I3(aq)
①t1 s之前,pH=4的溶液中比pH=7的溶液中I3-的浓度大的原因是__________。
②t1 s之后,溶液中I3-的浓度逐渐下降的原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以冶铝的废弃物铝灰为原料制取超细α-氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:
(1)铝灰中氧化铝与硫酸反应的化学方程式为 。
(2)用图中“滤渣”和NaOH焙烧制备硅酸钠,可采用的装置为 (填选项编号)。

(3)在实验流程中,加30%的H2O2溶液发生的离子反应方程式为 。
(4)验证“沉铁”后,溶液中是否还含有铁离子的操作方法为 。
(5)若用调节pH溶液“沉铁”,则得到Fe(OH)3,已知:25℃时,Ksp[Fe(OH)3]=4.0×10-38,则该温度下反应Fe3++3H2O![]() Fe(OH)3+3H+的平衡常数为 。
Fe(OH)3+3H+的平衡常数为 。
(6)煅烧硫酸铝铵晶体,发生的主要反应为:4[NH4Al(SO4)2·12H2O]![]() 2Al2O3+ 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。
2Al2O3+ 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。

①集气瓶中收集到的气体是 (填化学式)。
②KMnO4溶液褪色,发生的离子反应方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com