
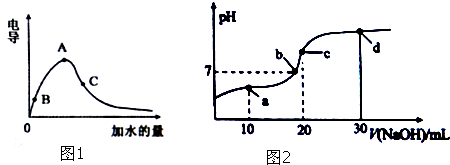
·ÖĪö £Ø1£©Ė®µÄĄė×Ó»ż³£ŹżĪŖĪĀ¶ČµÄŗÆŹż£¬ĪĀ¶Č²»±ä£¬Ė®µÄĄė×Ó»ż³£Źż²»±ä£»ČÜŅŗµÄµ¼µēÄÜĮ¦ÓėĄė×ÓÅØ¶Č³ÉÕż±Č£»
£Ø2£©ŃĪĖįŹĒĒæĖį£¬“×ĖįŹĒČõĖį£¬ĻąĶ¬ĪĀ¶ČĻĀ£¬µČĢå»ż”¢ĻąĶ¬pHÖµµÄŃĪĖįŗĶ“×ĖįČÜŅŗ£¬“×ĖįÅØ¶Č“ó£¬ÓėŠæ·“Ó¦£¬“×Ėį²śÉśµÄĒāĘų¶ą£»
£Ø3£©Ėį»ņ¼īŅÖÖĘĖ®µēĄė£¬ŗ¬ÓŠČõĄė×ÓµÄŃĪ“Ł½ųĖ®µēĄė£»bµć³ŹÖŠŠŌ£¬CµćŹĒ¼ÓČė20mlĒāŃõ»ÆÄĘČÜŅŗŗĶ“×Ėį·“Ó¦£¬µĆµ½ČÜŅŗÖŠŹĒ“×ĖįÄĘČÜŅŗ£¬dµćĪŖŅŅĖįÄĘ”¢ĒāŃõ»ÆÄĘČÜŅŗ£¬½įŗĻČÜŅŗÖŠµēĄėĖ®½ā·ÖĪö£®
½ā“š ½ā£ŗ£Ø1£©Ņ»¶ØĪĀ¶ČĻĀ£¬ĪĀ¶Č²»±ä£¬Ė®µÄĄė×Ó»ż³£Źż²»±ä£¬ĖłŅŌA”¢B”¢CČżµćĖ®µÄĄė×Ó»ż³£ŹżKw£ØA£©=Kw£ØB£©=Kw£ØC£©£¬ČÜŅŗµÄµ¼µēÄÜĮ¦ÓėĄė×ÓÅØ¶Č³ÉÕż±Č£¬øł¾ŻĶ¼ĻóÖŖ£¬ČÜŅŗµ¼µēÄÜĮ¦“óŠ”Ė³ŠņŹĒA£¾C£¾B£¬ŌņĒāĄė×ÓÅضČÓɓ󵽊”µÄĖ³ŠņĪŖĖ³ŠņŹĒA£¾C£¾B£¬ĖłŅŌĖįŠŌÓÉĒæµ½ČõµÄĖ³ŠņĪŖ£ŗA£¾C£¾B£¬
¹Ź“š°øĪŖ£ŗKw£ØA£©=Kw£ØB£©=Kw£ØC£©£»A£¾C£¾B£»
£Ø2£©ŃĪĖįŹĒĒæĖį£¬ĶźČ«µēĄė£¬“×ĖįŹĒČõĖį£¬²æ·ÖµēĄė£¬ĻąĶ¬ĪĀ¶ČĻĀ£¬µČĢå»ż”¢ĻąĶ¬pHÖµµÄŃĪĖįŗĶ“×ĖįČÜŅŗ£¬“×ĖįÅØ¶Č“ó£¬·Ö±šĻ”ŹĶn±¶£¬“×Ėį½ųŅ»²½µēĄė£¬ĘäČÜŅŗÖŠĒāĄė×ÓÅØ¶Č“óÓŚŃĪĖįµÄĒāĄė×ÓÅØ¶Č£¬ÓėŠæ·“Ó¦£¬“×Ėį²śÉśµÄĒāĘų¶ą£¬
¹Ź“š°øĪŖ£ŗŠ”ÓŚ£»Š”ÓŚ£»
£Ø3£©Ėį»ņ¼īŅÖÖĘĖ®µēĄė£¬bµć³ŹÖŠŠŌ£¬µĪČėµÄNaOHČÜŅŗĢå»żŠ”ÓŚ20mL£¬ČÜÖŹĪŖ“×ĖįÄĘŗĶ“×Ėį£¬“×ĖįµēĄė³Ģ¶ČµČÓŚ“×ĖįøłĄė×ÓĖ®½ā³Ģ¶Č£¬Ė®×ŌČ»µēĄė£¬cµćČÜÖŹĪŖ“×ĖįÄĘ£¬“×ĖįøłĄė×ÓĖ®½ā“Ł½ųĖ®µēĄė£¬dµćĪŖŅŅĖįÄĘ”¢ĒāŃõ»ÆÄĘČÜŅŗ£¬ČÜŅŗ³Ź¼īŠŌ£¬ŅÖÖĘĖ®µÄµēĄė£¬ĖłŅŌb”¢c”¢dČżµćµÄČÜŅŗÖŠ£¬Ė®µÄµēĄė³Ģ¶ČÓɓ󵽊”µÄĖ³ŠņĪŖ£ŗc£¾b£¾d£¬dµćČÜŅŗÖŠČÜŅŗ³Ź¼īŠŌ£¬C£ØOH-£©£¾C£ØH+£©£¬¼ÓČė30mlĒāŃõ»ÆÄĘČÜŅŗ£¬¼ÓČėµÄĒāŃõ»ÆÄʵÄĮæ“óÓŚŅŅĖįµÄĮ棬·“Ó¦ŗóC£ØNa+£©£¾C£ØCH3COO-£©£¬ĖłŅŌC£ØNa+£©£¾C£ØCH3COO-£©£¾C£ØOH-£©£¾C£ØH+£©£¬
¹Ź“š°øĪŖ£ŗC£ØNa+£©£¾C£ØCH3COO-£©£¾C£ØOH-£©£¾C£ØH+£©£®
µćĘĄ ±¾Ģāæ¼²éĮĖČõµē½āÖŹµÄµēĄė”¢Ėį¼ī»ģŗĻ”¢pHÓėÅØ¶ČµÄ¹ŲĻµ”¢ČÜŅŗµÄµ¼µēŠŌ”¢ĖįµÄĻ”ŹĶ¼°pHµÄ±ä»ÆµČÖŖŹ¶£¬Ć÷Č·ČÜŅŗµ¼µēÄÜĮ¦µÄÓ°ĻģŅņĖŲ”¢Čõµē½āÖŹµēĄė³Ģ¶ČÓėČÜŅŗÅØ¶ČµÄ¹ŲĻµŹĒ½ā±¾Ģā¹Ų¼ü£¬ÕżČ··ÖĪöĶ¼Ļó¼“æÉ£¬ĢāÄæÄѶČÖŠµČ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | HClO | B£® | NH4Cl | C£® | ÅØHNO3 | D£® | H2O2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
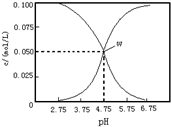
| A£® | øĆĪĀ¶ČĻĀ“×ĖįµÄµēĄėĘ½ŗā³£ŹżĪŖka=10-4.75 | |
| B£® | pH=6µÄČÜŅŗÖŠ£¬c£ØK+£©+c£ØH+£©-c£ØOH-£©+c£ØCH3COOH£©=0.1mol/L | |
| C£® | pH=3.75µÄČÜŅŗÖŠc£ØCH3COO-£©£¾c£ØCH3COOH£©£¾c£ØH+£©£¾c£ØOH-£© | |
| D£® | ĻņWµćĖłŹ¾ČÜŅŗÖŠĶØČė0.1molHClĘųĢå£ØČÜŅŗĢå»żæÉŅŌŗöĀŌ²»¼Ę£©c£ØH+£©=c£ØOH-£©+c£ØCH3COOH£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĻņĘÆ°×ŅŗÖŠĶØČėÉŁĮæCO2£ŗ2ClO-+CO2+H2OØT2HClO+CO32- | |
| B£® | ÓĆ°±Ė®ĪüŹÕ×ćĮ涞Ńõ»ÆĮņ£ŗSO2+NH3•H2OØTHSO3-+NH4+ | |
| C£® | ÓĆ×ćĮæµÄŃõŃõ»ÆÄĘČÜŅŗĪüŹÕ¶žŃõ»ÆµŖ£ŗ3NO2+2OH-ØT2NO3-+NO+H2O | |
| D£® | “ĪĀČĖįøĘČÜŅŗÖŠĶØČėÉŁĮæSO2ĘųĢå£ŗCa2++2ClO-+SO2+H2OØTCaSO3”ż+2HClO |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 13 | B£® | 14 | C£® | 15 | D£® | ²»ÄÜČ·¶Ø |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | µ„ÖŹ·Šµć£ŗW£¾Y | |
| B£® | XµÄ×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦µÄĖ®»ÆĪļÄÜÓėYµÄŃõ»ÆĪļ·“Ó¦ | |
| C£® | WÓėXŠĪ³ÉµÄ»ÆŗĻĪļÖŠŗ¬ÓŠ¹²¼Ū¼ü | |
| D£® | ¼ņµ„Ąė×ӵİė¾¶£ŗX£¾Y£¾Z |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ±ź×¼×“æöĻĀ£¬11.2LCHCl3ŗ¬ÓŠ¹²¼Ū¼üŹżĪŖ2NA | |
| B£® | ijĪĀ¶ČĻĀ£¬“æĖ®pH=6£¬øĆĪĀ¶ČĻĀ1LpH=11µÄNaOHČÜŅŗÖŠŗ¬ÓŠOH-ŹżÄæĪŖ0.1NA | |
| C£® | ŗ¬3.65gHClµÄĖ®ČÜŅŗÖŠŗ¬ÓŠĮ£×ÓŹżĪŖ0.2NA | |
| D£® | 0.2mol/LNa2SČÜŅŗÖŠŗ¬ÓŠS2-ŹżÄæŠ”ÓŚ0.2NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ČĪŗĪĖįÓė¼ī·¢ÉśÖŠŗĶ·“Ӧɜ³É1mol H2OµÄ¹ż³ĢÖŠ£¬ÄÜĮæ±ä»Æ¾łĻąĶ¬ | |
| B£® | ŅŃÖŖ£ŗC £Øs£¬ŹÆÄ«£©=C £Øs£¬½šøÕŹÆ£©”÷H=+1.5 kJ•mol-1£¬Ōņ½šøÕŹÆ±ČŹÆÄ«øüĪČ¶Ø | |
| C£® | Čō¢Ł2H2 £Øg£©+O2 £Øg£©=2H2O £Øg£©”÷H=-a kJ•mol-1£¬¢Ś2H2 £Øg£©+O2 £Øg£©=2H2O £Øl£©”÷H=-b kJ•mol-1£¬Ōņ b£¾a | |
| D£® | ÄÜ×Ō·¢½ųŠŠµÄ·“Ó¦Ņ»¶ØŹĒ·ÅČČ·“Ó¦£¬²»ÄÜ×Ō·¢½ųŠŠµÄ·“Ó¦Ņ»¶ØŹĒĪüČČ·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
| A£® | NaF£¾NaCl£¾NaBr£¾NaI | B£® | Na20£¾Na2S£¾NaCl£¾NaI | ||
| C£® | NaCl£¾CaCl2£¾MgCl2£¾AlCl3 | D£® | MgCO3£¾CaCO3£¾SrCO3£¾BaCO3 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com