
【题目】某化学兴趣小组探究铝与稀盐酸反应速率的影响因素,用等质量的铝和等体积、等浓度的足量稀盐酸反应,得到的3组实验数据如下:
实验编号 | 铝的形状 | 反应温度/℃ | 收集100mLH2所需的时间 |
① | 铝粉 | 20 | 21 |
② | 铝片 | 20 | 82 |
③ | 铝片 | 30 | 35 |
回答下列问题:
(1)写出铝与稀盐酸反应的化学方程式______________________。
(2)探究温度对该反应速率影响的对比实验是③和_______ (填实验编号),得出的实验结论是________。
(3)若将该实验中“收集100mL H2所需时间改为“测量相同时间内生成H2的体积”,可选用的排水量气装置为下图中的______________(填装置代号)。
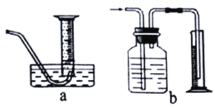
【答案】2Al+6HCl=2AlCl3+3H2 ↑ ② 相同条件下,温度越高反应速率越快 a
【解析】
从表中可以看出,探究铝与稀盐酸反应速率的影响因素,实验探究的内容有两个:一个是探究铝的形状对反应速率的影响,另一个是探究温度对反应速率的影响。需要注意的是,探究外界条件对反应速率的影响时,只能有一个自变量。所以,探究铝的形状对反应速率的影响时,应采用实验①②进行比较分析;探究温度对反应速率的影响时,应使用实验②③进行比较分析。
(1)铝与稀盐酸发生置换反应,生成氯化铝和氢气,化学方程式为2Al+6HCl=2AlCl3+3H2 ↑。答案为:2Al+6HCl=2AlCl3+3H2 ↑;
(2)探究温度对该反应速率影响时,铝的形状应相同,只有温度不同,所以对比实验是③和②;从实验中可以看出,温度高的实验,相同时间内产生的气体量多,由此得出的实验结论是相同条件下,温度越高反应速率越快。答案为:②;相同条件下,温度越高反应速率越快;
(3)在两个装置中,a装置中气体进入量筒,能排出量筒内的水,且排出水的体积等于生成气体的体积,而b装置是一个洗气装置,而不是排液法收集气体的装置,所以可选用的排水量气装置为图中的a。答案为:a。


科目:高中化学 来源: 题型:
【题目】请写出下列各题中的离子方程式或化学方程式
(1)碳酸钠与硝酸反应的离子方程式:_________。
(2)二氧化硅与氢氧化钠反应的离子方程式:_____________。
(3)写出工业制硅所涉及的化学方程式:a.__________b.__________c.____________。
(4)写出氢氧化镁与盐酸反应的离子方程式:____________。
(5)请写出一个离子方程式证明溴的氧化性大于碘:_________。
(6)写出一个化学方程式其离子反应为CO32-+2H+=CO2+H2O:______。
(7)写出一种酸在常温下能与硅反应的化学方程式:_______________。
(8)写出用HF雕刻玻璃的化学方程式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法错误的是
A.标准状况下,22.4 L环丙烷和丙烯的混合气体中所含共用电子对数为9NA
B.56g铁在足量氧气中完全燃烧,转移的电子数小于3NA
C.16g O2和14C2H4的混合物中所含中子数为8NA
D.常温下,1 L 0.5 mol/L CH3COONH4溶液的pH=7,则溶液中CH3COO-与NH4+的数目均为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出表示含有8个质子、10个中子的原子的符号__________。
(2)画出Si原子的原子结构示意图 ________________________。
(3)写出H2O的电子式 ________
(4)第34号元素在元素周期表中的位置____________、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故。将变黑的银质器皿放入下图装置,一段时间后发现黑色会褪去。回答下列问题:
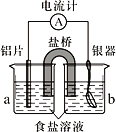
(1)铝为________极,KNO3盐桥中的________离子进入a烧杯中,银器的电极反应式为________。
(2)如不用盐桥,将铝片和银器插入一个盛食盐水的烧杯中处理,负极的电极反应式是_________,总反应方程式_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用可溶性钡盐检验 SO![]() 离子的存在时,先在待测溶液中加入盐酸,其作用是( )
离子的存在时,先在待测溶液中加入盐酸,其作用是( )
A.形成较多的白色沉淀
B.形成的沉淀纯度更高
C.排除 SO![]() 以外的其它阴离子及 Ag+的干扰
以外的其它阴离子及 Ag+的干扰
D.排除 Ba2+以外的其它阳离子的干扰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同体积、相同pH的氨水和氢氧化钠溶液加水稀释时的pH变化曲线如下图所示,下列判断正确的是

A. b点溶液导电能力比a点溶液强
B. 对于b、c两点,电离平衡常数Kb>Kc
C. 与盐酸完全反应时,消耗盐酸体积:Va>Vc
D. X的值接近7,但大于7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用O2将HCl转化为Cl2,可提高效益、减少污染。新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性。
①实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的αHCl~T曲线如图,则总反应的ΔH__0(填“>”、“=”或“<”);A、B两点的反应速率中较大的是__。

②下列措施有利于提高αHCl的有____(填字母)。
A.增大n(HCl) B. 增大n(O2)
C. 使用更好的催化剂 D. 移去H2O
(2)乙苯催化脱氢制苯乙烯反应:![]() +H2(g),工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1∶9),控制反应温度600 ℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如图。
+H2(g),工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1∶9),控制反应温度600 ℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如图。
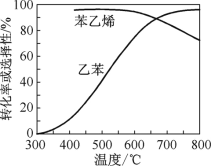
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实:_________。
②控制反应温度为600 ℃的理由是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷与氧气反应过程中的能量变化如图所示。下列有关说法中正确的是( )
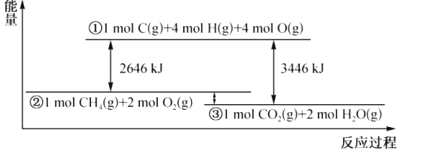
A.CH4(g)的能量大于CO2(g)和H2O(g)的能量总和
B.反应CH4(g)+2O2(g)=CO2(g)+2H2O(1) △H=-800kJmol-1
C.若破坏1molO2(g)中的化学键需吸收热量493kJ,则破坏1molC-H键需吸收热量415kJ
D.在反应CH4(g)+2O2(g)═CO2(g)+2H2O(g)中,放出热量400kJ,有1molO-H键生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com