
【题目】1934年居里夫妇用α粒子轰击![]() 得到一种自然界不存在的核素
得到一种自然界不存在的核素![]() ,开创了人造核素的先河。其发生的变化如下:
,开创了人造核素的先河。其发生的变化如下:![]() +
+![]() →
→![]() +
+![]() 。下列有关说法错误的是
。下列有关说法错误的是
A.![]() 和
和![]() 两种原子互为同位素
两种原子互为同位素
B.在![]() 中,质子数=中子数=核外电子数
中,质子数=中子数=核外电子数
C.该变化同样遵循质量守恒定律
D.该变化说明原子核在化学反应中也能发生变化
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】氢溴酸是无色、易挥发的液体,在化工领域用途广泛。实验室模拟一种工业制备氢溴酸的主要流程如下:
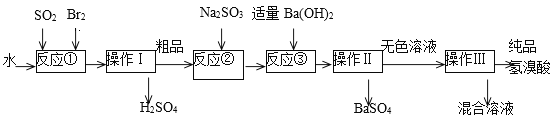
(1)写出反应①的离子方程式___________该反应需要在冰水浴中进行,可能的原因是____________。
(2)操作I的名称__________。
(3)反应②中Na2SO3的目的是_____________________。
(4)操作Ⅱ用到的玻璃仪器有烧杯、_____________________。
(5)工业生产中制得的氢溴酸带有淡淡的黄色。于是甲乙两同学设计了实验加以探究:
①甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为_________,若假设成立可观察到的现象为____________________。
②乙同学假设工业氢溴酸呈淡黄色是因为____,其用于证明该假设成立的方法为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
A.0.1 mol·L-1(NH4)2Fe(SO4)2溶液中:c(![]() )>c(
)>c(![]() )>c(Fe2+)>c(H+)
)>c(Fe2+)>c(H+)
B.pH=11的氨水和pH=3的盐酸溶液等体积混合,所得溶液中:c(Cl-)>c(![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
C.在0.1 mol·L-1 Na2CO3溶液中:2c(Na+)=c(![]() )+c(
)+c(![]() )+c(H2CO3)
)+c(H2CO3)
D.0.1 mol·L-1的醋酸钠溶液20 mL与0.1 mol·L-1盐酸10 mL混合后溶液显酸性:c(CH3COO-)> c(Cl-)> c(CH3COOH)> c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积容器中发生反应:2CH4(g)+2NH3(g)+3O2(g)=2HCN(g)+6H2O(g),15分钟内测得反应速率用HCN表示为v(HCN)=0.36 mol/(L·min),该段时间内下列表示正确的是( )
A.15分钟内反应消耗氨气5.4 mol
B.该时间内可用水表示反应速率为v(H2O)=1.08 mol/(L·min)
C.各物质的速率关系有:2v(CH4)=2v(NH3)=3v(O2)
D.15分钟内氧气浓度下降8.1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学查阅资料得知25℃时部分弱酸的电离常数如下表:
酸 | HCOOH | HClO | H2CO3 | H2C2O4 | H2S |
电离常数(Ka) | 1.8×10-4 | 3×10-8 | K1=4.4×10-7 K2=4.7×10-11 | K1=5.4×10-2 K2=5.4×10-5 | K1=1.3×10-7 K2=7.1×10-15 |
据此回答以下几个问题:
(1)四位同学根据表中数据写出以下几个反应方程式
甲:![]()
乙:![]()
丙:![]()
丁:![]()
上述反应可以成功进行的是______(填同学代号)。
(2)甲同学为证明 HCOOH 为弱酸,采用以下方法一定能证明的是_______(填序号)。
①常温下测得HCOONa溶液的pH大于7
②用HCOOH 溶液做导电实验,灯泡很暗
③HCOOH与Na2S能发生反应产生臭鸡蛋气味的气体
④采用pH计测得常温下 0.1 mol/L HCOOH 溶液的pH=1.37
⑤HCOONa和H3PO4反应,生成 HCOOH
⑥pH=2的HCOOH溶液稀释至100倍后,测得pH约为3.4
(3)乙同学取10.00 mL 0.1 mol/L H2C2O4在室温下用0.1 mol/L NaOH 溶液进行滴定,并使用氢离子浓度监测仪进行实时监控,当电脑显示 pH=7并稳定时停止滴定,此时测得消耗NaOH 溶液体积为V mL。
①该实验可使用________量取10.00 mL 0.1 mol/L H2C2O4(填仪器名称)。
②V____10.00 mL(填“>”“="或“<”)。
③滴定结束后溶液中所含离子浓度由大到小为:_________(书写离子浓度符号并用“>”连接)。
④丙同学与甲同学做同样实验。但他将0.1 mol/L H2C2O4换成0.1 mol/L H2S溶液,丙同学实验结束后溶液c(HS-)___ c(S2-)(填">""<"或“=”)。
(4)已知酸性高锰酸钾可将甲酸氧化成二氧化碳,丁采用 HCOOH 溶液对某KMnO4样品进行纯度测定(杂质不参导反应),取0.200 g KMnO4样品(M=158 g/mol)在锥形瓶中溶解并酸化后,用0.100 mol/L的标准HCOOH溶液进行滴定,滴定至终点时消耗 HCOOH 溶液20.00 mL。
①对 KMnO
②确定达到滴定终点的判断方法是_________。
③该样品中KMnO4的纯度为 _______(用百分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、R、X、Y、Z五种元素的原子序数依次递增。已知:①Z的原子序数为26,其余的均为短周期主族元素;②Y原子价电子(外围电子)排布msnmpn ③R原子核外L层电子数为奇数;④Q、X原子p轨道的电子数分别为2和4。请回答下列问题:
(1)R3- 的核外电子排布式是____________________________;
(2)写出Z(OH)3加热的化学方程式_________________________;
(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是________,
a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
(4)Q、R、Y三种元素的原子半径从大到小的顺序为____________(用元素符号作答)
(5)Q的一种氢化物相对分子质量为26,其电子式为__________________
(6)X和Y形成的化合物晶体属于____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示化学反应的离子方程式正确的是
A.![]() 溶液中滴入稀盐酸:SO32-+2H+=H2O+SO2↑
溶液中滴入稀盐酸:SO32-+2H+=H2O+SO2↑
B.用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+=Cu2++2Fe2+
C.碳酸钙溶于稀醋酸:CaCO3+2H+=Ca2++H2O+CO2↑
D.钠与硫酸铜水溶液反应:2Na+Cu2+=Cu+2Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,依次进行如下实验:
①取一定量冰醋酸,配制成100mL0.1mol/L醋酸溶液;
②取20mL①中所配溶液,加入20mL0.1mol/LNaOH溶液;
③继续滴加amL0.1mol/L稀盐酸,至溶液的pH=7。
下列说法正确的是
A.①中溶液的pH=1
B.②中反应后溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.③中,a=20
D.③中,反应后溶液:c(Na+)=c(CH3COO-)+c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,原理示意图如图,下列说法不正确的是
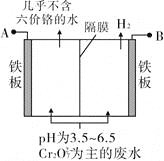
A. A接电源正极
B. 阳极区溶液中发生的氧化还原反应为Cr2O72-+6Fe2++14H+===2Cr3++6Fe3++7H2O
C. 阴极区附近溶液pH降低
D. 若不考虑气体的溶解,当收集到H213.44 L(标准状况)时,有0.1 mol Cr2O72-被还原
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com