
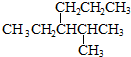 的命名正确的是( )
的命名正确的是( )| A. | 4-甲基-3-丙基戊烷 | B. | 3-异丙基己烷 | ||
| C. | 2-甲基-3-丙基戊烷 | D. | 2-甲基-3-乙基己烷 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
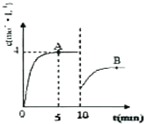 自1913年工业合成氨投产以来,合成氨工业不断发展,氨又可以进一步制备硝酸,在工业上可进行连续生产.请回答下列问题:
自1913年工业合成氨投产以来,合成氨工业不断发展,氨又可以进一步制备硝酸,在工业上可进行连续生产.请回答下列问题:| t/K | 298 | 398 | 498 | … |
| K | 4.1×106 | K1 | K2 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和乙烷 | B. | 乙烷和丙烯 | C. | 甲烷和乙烯 | D. | 丙烯和丙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
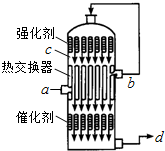 在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室(见图).下列说法错误的是( )
在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室(见图).下列说法错误的是( )| A. | a、b两处的混合气体成分含量相同,温度不同 | |
| B. | c、d两处的混合气体成分含量相同,温度不同 | |
| C. | 热交换器的作用是预热待反应的气体,冷却反应后的气体 | |
| D. | c处气体经热交换后再次催化氧化的目的是提高SO2的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
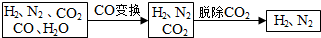
| Na2CO3 | K2CO3 | |
| 20℃碱液最高浓度(mol/L) | 2.0 | 8.0 |
| 碱的价格(元/kg) | 1.25 | 9.80 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 卤素的氢化物中沸点最低的是HF | |
| B. | 因为H2O分子间有氢键,所以H2O比H2S稳定 | |
| C. | 一个X原子的质量为ag,则X元素的相对原子质量为aNA | |
| D. | 熔沸点:NH3<PCl3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com