
| A. | 煤的主要成分是焦炭和无机物杂质 | |
| B. | 用家用汽车代替公交车不能达到节能减排的目的 | |
| C. | 汽车尾气的大量排放不仅会造成酸雨还可能引起光化学烟雾 | |
| D. | 添加三聚氰胺能增加奶制品的N元素含量,但是对人体有害 |
分析 A.煤在隔绝空气条件下加热生成焦炭;
B.用家用汽车代替公交车,不能节能减排;
C.汽车尾气中含有氮的氧化物;
D.长期食用含三聚氰胺的食品可致人体的泌尿系统出现结石.
解答 解:A.煤在隔绝空气条件下加热生成焦炭,所以焦炭是煤反应后的产物,不是煤的成分,故A错误;
B.用家用汽车代替公交车,家用汽车产生的有害气体更多,所以不能节能减排,故B正确;
C.汽车尾气中含有氮的氧化物,氮的氧化物与雨水反应生成硝酸,会形成酸雨,而且氮的氧化物能引起光化学烟雾,故C正确;
D.三聚氰胺化学式是C3N6H6,氮元素的质量分数高达66.7%,但三聚氰胺有轻微毒性,长期食用含三聚氰胺的食品可致人体的泌尿系统出现结石,不能在奶制品中加入三聚氰胺,故D正确;
故选A.
点评 本题考查化学与环境保护、生产、生活的关系,题目难度不大,要求学生能够用化学知识解释化学现象,试题培养了学生的分析、理解能力及灵活应用基础知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | ①和② | B. | ①和③ | C. | ②和③ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
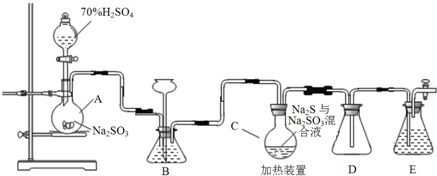
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
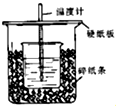 50ml0.50mol/L盐酸和50ml0.55mol/LNaOH溶液在如下图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
50ml0.50mol/L盐酸和50ml0.55mol/LNaOH溶液在如下图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大压强,化学平衡不一定发生移动 | |
| B. | 通入与反应无关的氦气,化学平衡不发生移动 | |
| C. | 增大X或Y的物质的量,化学平衡一定发生移动 | |
| D. | 其它条件不变,升高温度,化学平衡一定发生移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
| 序号 | 氢氧化钡溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 13 |
| ② | 22.00 | 18.00 | 12 |
| ③ | 22.00 | 22.00 | 7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com