
| 应称取NaOH的质量/g | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其他玻璃仪器 |
分析 (1)依据配制溶液体积选择容量瓶规格,依据m=CVM计算需要溶质的质量;依据配制一定物质的量浓度一般步骤选择需要仪器;
(2)根据容量瓶的构造解答;
(3)配制一定物质的量浓度溶液一般步骤为:计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶贴标签,据此排序;容量瓶瓶颈较细,移液应用玻璃棒引流;定容时,继续往容量瓶内小心加水,眼睛注视凹液面最低处,最后用胶头滴管逐滴滴加水到凹液面最低处于刻度线相切;
(4)分析操作对溶质的物质的量和溶液体积的影响,依据c=$\frac{n}{V}$进行误差分析.
解答 解:(1)配制480mL0.2mol•L-1的NaOH溶液,实验室没有480mL容量瓶,应选择500mL容量瓶,实际配制500mL溶液,需要溶质的质量=0.2mol/L×40g/mol×0.5L=4.0g;
配制一定物质的量浓度溶液一般步骤为:计算、称量、溶解、移液、洗涤、定容、摇匀,用到的仪器:托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管,所以还需要的玻璃仪器:烧杯、玻璃棒、胶头滴管;
故答案为:4.0; 500mL容量瓶; 烧杯、玻璃棒、胶头滴管;
(2)容量瓶的定量仪器,所以标有容积和刻度,温度影响溶液的体积,所以容量瓶上还标有使用的温度;
故选:①③⑤;
(3)配制一定物质的量浓度溶液一般步骤为:计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶贴标签,所以正确的顺序为:BCAFED;
C.容量瓶瓶颈较细,移液应用玻璃棒引流,故答案为:玻璃棒;
E.定容时,最后用胶头滴管逐滴滴加水到凹液面最低处与刻度线相切;
F.定容时,继续往容量瓶内小心加水,眼睛注视凹液面最低处;
故答案为:凹液面最低处与刻度线相切;凹液面最低处;
(4)A.在烧杯中稀释溶质搅拌时,溅出少量溶液,导致溶质部分损耗,溶质的物质的量偏小,溶液浓度偏低,故A选;
B.没有用蒸馏水洗烧杯2~3次,未将洗液移人容量瓶中,导致质部分损耗,溶质的物质的量偏小,溶液浓度偏低,故B选;
C.定容时,加水超过了刻度线,倒出一些再重新加水到刻度线,导致溶液体积偏大,溶液浓度偏低,故C不选;
D.溶液具有均一性,将所配溶液从容量瓶转移到试剂瓶时,有少量溅出,溶液浓度不变,故D不选;
E.容量瓶刚用蒸馏水洗净,没有烘干,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,故E不选;
故选:ABC.
点评 本题考查了配制一定物质的量浓度的溶液的方法及误差分析,明确配制原理及操作步骤是解题关键,侧重对学生能力的培养和解题方法的指导和训练,题目难度不大.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:填空题
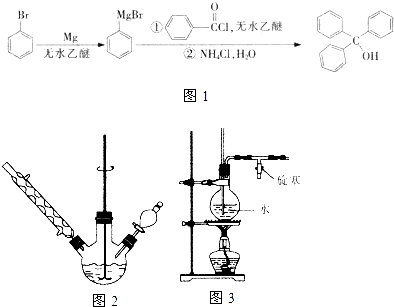 三苯甲醇是一种重要有机合成中间体,可以通过下列原理进行合成:实验步骤如下:
三苯甲醇是一种重要有机合成中间体,可以通过下列原理进行合成:实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
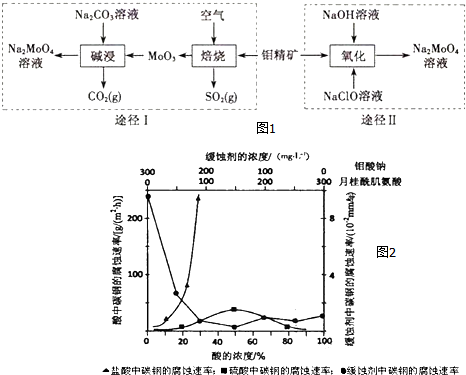
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
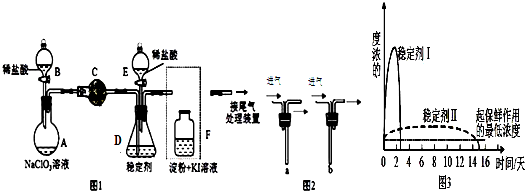
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质发生化学反应都伴随着能量的变化,伴有能量变化的物质变化都是化学变化 | |
| B. | 101kPa时,2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1,H2(g)的燃烧热为285.8kJ•mol-1 | |
| C. | 在相同条件下的稀溶液中,1molHCl、1molHNO3分别与足量NaOH充分反应,放出的热量相等 | |
| D. | H2+Cl2═2HCl的能量变化情况可用如图表示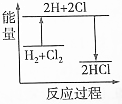 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑥⑨ | B. | ①②④⑨ | C. | ③⑤⑥⑧ | D. | ①②③④⑤⑥⑦⑧⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物 质 | 熔点/℃ | 沸点/℃ | 密度(20℃)/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 浓硝酸 | - | 83 | 1.4 | 易溶于水 |
| 浓硫酸 | - | 338 | 1.84 | 易溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com