
分析 (1)三价铁离子具有强的氧化性能够氧化硫化氢生成单质硫;
(2)阴极二价铁离子失去1个电子生成三价铁离子;
(3)结合绿色化学的理论并根据FeCl3可以循环利用确定该实验的有两个显著优点;
解答 解:(1)FeCl3与H2S反应生成硫单质、二价铁离子和水,离子方程式为 2Fe3++H2S=2Fe2++S↓+2H+;
故答案为:2Fe3++H2S=2Fe2++S↓+2H+;
(2)阴极二价铁离子失去1个电子生成三价铁离子,电极反应式:Fe2+-e-=Fe3+;
故答案为:Fe2+-e--=Fe3+;
(3)根据实验原理可知,电解池中最终得到的FeCl3可重新用来吸收H2S,得到循环利用,
故答案为:FeCl3可以循环利用.
点评 本题考查了离子方程式、电极反应式的书写,明确三价铁离子性质、电解池工作原理是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
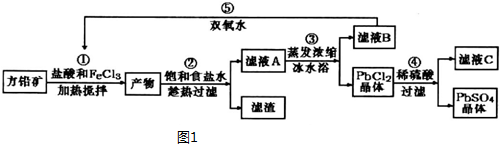
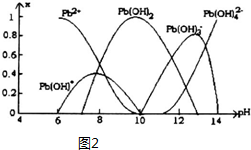
| 离子 | Pb2+ | Ca2+ | Fe3+ | Mn2+ |
| 处理前浓度/(mg•L-1) | 0.100 | 29.8 | 0.12 | 0.087 |
| 处理后浓度/(mg•L-1) | 0.004 | 22.6 | 0.04 | 0.053 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑦⑧ | B. | ②③④⑥⑦ | C. | ③④⑥⑦⑧ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
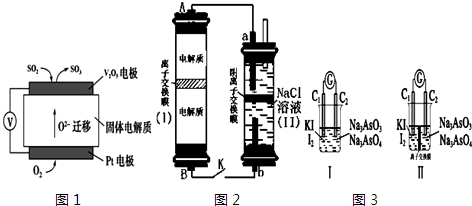
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
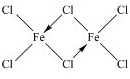 ,你认为该分子是否为平面形分子?否(填“是”或“否”).
,你认为该分子是否为平面形分子?否(填“是”或“否”).
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
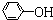 )具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子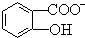 能形成分子内氢键.据此判断,相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚)(填“>”或“<”),其原因是
能形成分子内氢键.据此判断,相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚)(填“>”或“<”),其原因是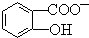 中形成分子内氢键,使其更难电离出H+.
中形成分子内氢键,使其更难电离出H+.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
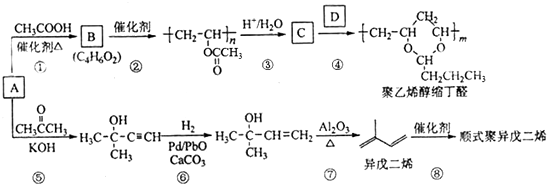
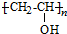 、CH3CH2CH2CHO.
、CH3CH2CH2CHO.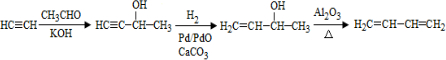 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 给试管中的铜与浓硫酸加热,发现试管底部有白色固体并夹杂有少量黑色物质,此白色固体为硫酸铜,黑色固体为氧化铜 | |
| B. | SO2通入足量的Fe(NO3)3稀溶液中,溶液有棕黄色变为浅绿色,但立即又变成棕黄色,说明氧化性:HNO3>稀硫酸>Fe3+ | |
| C. | 配制一定物质的量浓度溶液时发现浓度偏低,可能由于配制溶液所用的容量瓶事先未干燥 | |
| D. | 浓硝酸在光照条件下变黄,说明浓硝酸不稳定,生成的有色产物能溶于浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 离子 | Cu2+ | Al3+ | NO3- | Cl- |
| 物质的量浓度(mol/L) | 1 | 1 | a | 1 |
| A. | 阳极生成1.5mol Cl2 | B. | a=3 | ||
| C. | 电解后溶液中c(H+)=1moL/L | D. | 阴极析出的金属是铜与铝 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com