
一种海水电池的反应原理可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,有关该反应的说法正确的是
A.反应中MnO2是还原剂
B.Ag的还原性比Na2Mn5O10强
C.该反应中MnO2具有催化作用
D.每生成1 mol Na2Mn5O10转移1 mol电子
科目:高中化学 来源: 题型:
| ||
| TiO2 |
查看答案和解析>>
科目:高中化学 来源:湖北省黄冈中学、黄石二中2011-2012学年高二下学期期中联考化学试题 题型:022
短周期元素A、B、C、D、E、F的原子序数依次增大,其中A为周期表中原子半径最小的元素;B原子的最外层电子排布为nsnnpn;C是地壳中含量最高的元素;Cn-、D+、E3+具有相同的电子层结构,E、F的质子数之和是Cn-电子数的3倍.试回答下列问题:
(1)A与B组成的一种分子中所有原子共直线,该分子中B原子杂化方式是________.
(2)D与F形成的化合物其晶体结构模型如图,它代表该晶体的一个结构单元.(图中小黑点、小白圈分别代表阴、阳离子)
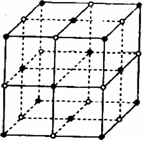
①此结构单元中与D+距离最近且相等的D+离子个数为________.
②已知该晶体的密度为r g/cm3,该化合物摩尔质量Mg/mol,阿伏加德罗常数为NA,则在该晶体里距离最近的阳离子和阴离子之间的核间距大约是:________cm.
(3)我国首创利用C、E两元素单质在海水中的反应所设计的原电池广泛运用于海水标示灯,该电池的正极反应式为________.
查看答案和解析>>
科目:高中化学 来源: 题型:
(安徽08高考前信息卷)
短周期元素A、B、C、D、F、F的原子序数依次增大,其中A为周期表中原子半径最小的元素; B原子的最外层电子数是其次外层电子数的2倍;C是地壳中含量最高的元素;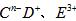 具有相同的电子层结构,E、F的质子数之和是
具有相同的电子层结构,E、F的质子数之和是 电于数的3倍。试回答下列问题:
电于数的3倍。试回答下列问题:
(1)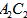 的电子式为_____________________________。
的电子式为_____________________________。
(2)由A和B两元素可以组成一种直线型的有机物Y,其密度在标准状况下约为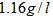 ,已知2克Y完全燃烧可以放出
,已知2克Y完全燃烧可以放出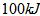 量,写出表示Y燃烧热的热化学方程式:
量,写出表示Y燃烧热的热化学方程式:
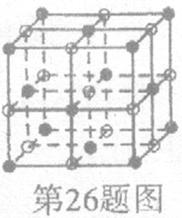
(3)D与F形成的化合物其晶体结构模型如图,它代表该晶体的一个结构单元。(图中小黑点、小白圈分别代表阴、阳离子)
①此结构单元中与 距离最近且相等的
距离最近且相等的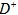 离子个数为_____________。
离子个数为_____________。
②此晶体熔化后用惰性电极电解,其电解方程式为:__________________________________________。
(4)我国首创利用C、E两元素单质在海水中的反应所设计的原电池广泛运用于海水标示灯,该电池的正极反应式为___________________________________________。
(5)将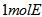 的最高价氧化物的水化物用适量的稀硫酸恰好溶解后,再加人1mol/L的D的最高价氧化物的水化物的水溶液后,生成沉淀39g。则加入1mol/L的D的最高价氧化物的水化物的水溶液的体积可能为____________________________________。
的最高价氧化物的水化物用适量的稀硫酸恰好溶解后,再加人1mol/L的D的最高价氧化物的水化物的水溶液后,生成沉淀39g。则加入1mol/L的D的最高价氧化物的水化物的水溶液的体积可能为____________________________________。
查看答案和解析>>
科目:高中化学 来源:期中题 题型:填空题
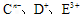 具有相同的电子层结构,E、F的质子数之和是
具有相同的电子层结构,E、F的质子数之和是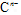 电子数的3倍。试回答下列问题:
电子数的3倍。试回答下列问题: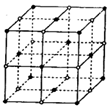
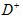 距离最近且相等的
距离最近且相等的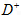 离子个数为_____________。
离子个数为_____________。 查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素A、B、C、D、E、F的原子序数依次增大,其中A为周期表中原子半径最小的元素;B原子的最外层电子排布为nsnnpn;C是地壳中含量最高的元素;![]() 具有相同的电子层结构,E、F的质子数之和是
具有相同的电子层结构,E、F的质子数之和是![]() 电子数的3倍。试回答下列问题:
电子数的3倍。试回答下列问题:
(1)A与B组成的一种分子中所有原子共直线,该分子中B原子杂化方式是 。
(2)D与F形成的化合物其晶体结构模型如图,它代表该晶体的一个结构单元。(图中小黑点、小白圈分别代表阴、阳离子)
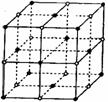
①此结构单元中与![]() 距离最近且相等的
距离最近且相等的![]() 离子个数为_____________。
离子个数为_____________。
②已知该晶体的密度为rg/cm3,该化合物摩尔质量Mg/mol,阿伏加德罗常数为NA,则在该晶体里距离最近的阳离子和阴离子之间的核间距大约是:_____________cm。
(3)我国首创利用C、E两元素单质在海水中的反应所设计的原电池广泛运用于海水标示灯,该电池的正极反应式为___________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com