
【题目】乙炔是一种无色无味的气体,微溶于水,易溶于有机溶剂。实验室常用如图所示装置制取乙炔,并验证乙炔的性质。完成实验,观察实验现象,回答下列问题:
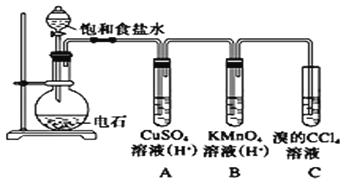
(1)写出电石(碳化钙CaC2)与水反应,制取乙炔的化学方程式_________
(2)用饱和食盐水代替蒸馏水的目的是____________
(3)装置A的作用是_________,装置B中的现象是___________
(4)若称取a g CaC2,反应完全后,将生成的乙炔全部通入足量溴的CCl4溶液中溶液增重b g,则CaC2的纯度为____________(用百分数表示)
【答案】CaC2+2H2O―→Ca(OH)2+HC≡CH↑ 减慢反应速率 除H2S等气体 紫色溶液褪色 64b/26a×100%
【解析】
电石(碳化钙CaC2)与水反应生成乙炔和氢氧化钙,为减慢反应速率,可以用饱和食盐水代替蒸馏水;所得乙炔气体中含有杂质气体硫化氢,可以用硫酸铜溶液除去;高锰酸钾溶液能够氧化乙炔,本身褪色;乙炔能够与溴发生加成反应,根据溴的四氯化碳溶液增加的质量可以计算出乙炔的物质的量,根据CaC2+2H2O―→Ca(OH)2+HC≡CH↑反应计算出纯的碳化钙的量和质量,进而计算出电石的纯度。
(1)电石(碳化钙CaC2)与水反应生成乙炔和氢氧化钙,反应的化学方程式为:CaC2+2H2O→Ca(OH)2+HC≡CH↑;
故答案是:CaC2+2H2O→Ca(OH)2+HC≡CH↑;
(2)制备乙炔需要消耗H2O,会使饱和食盐水中的NaCl析出,覆盖在电石表面,减小电石与H2O的接触,减慢反应速率;所以用饱和食盐水代替蒸馏水的目的是减慢反应速率;
故答案是:减慢反应速率;
(3)电石(碳化钙CaC2)与水反应生成乙炔的过程中,会有杂质气体硫化氢等产生,装置A的作用是除H2S等气体;乙炔属于不饱和烃,含有碳碳三键,能够与酸性高锰酸钾溶液发生氧化还原反应,乙炔被氧化,紫色高锰酸钾溶液被还原为无色溶液,故装置B中的现象是紫色溶液褪色;
故答案是:除H2S等气体;紫色溶液褪色;
(4)溴的CCl4溶液中溶液增重b g为乙炔气体的质量,所以n(C2H2)==b/26mol;根据CaC2+2H2O→Ca(OH)2+HC≡CH↑可知,n(CaC2)= n(C2H2)= b/26mol,m(CaC2)=64g/mol×b/26mol= 64b/26a×100%;
故答案是:64b/26a×100%。


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】所谓合金,就是不同种金属(也包括一些非金属)在熔化状态下形成一种熔合物,根据下列四种金属的熔沸点,其中不能形成合金的是
Na | Cu | Al | Fe | |
熔点/ | 97.5 | 1083 | 660 | 1535 |
沸点/ | 883 | 2595 | 2200 | 3000 |
A.Cu和AlB.Fe和CuC.Fe和NaD.A1和Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的密闭容器中,不能说明可逆反应H2(g)+I2(g)![]() 2HI(g)已经达到平衡的标志是( )
2HI(g)已经达到平衡的标志是( )
A.HI的生成速率与HI的分解速率相等
B.HI的生成速率与H2的生成速率之比是2∶1
C.单位时间内一个H-H键断裂的同时有两个H-I键断裂
D.单位时间里断裂2nmolHI的同时生成nmolI2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下图实验装置验证通过改变浓度来实现反应,2Fe3++2I-=2Fe2++I2中Fe3+与Fe2+的相互转化。K 闭合时,电流表指针第一次发生偏转,当指针归零后,向左管滴油加0.01mol/L的AgNO3溶液,发现指针第二次偏转,方向相反。下列有关说法不正确的是( )

A. 指针第一次偏转时,b极反应式为Fe3++e-=Fe2+
B. 加入AgNO3后,a为正极
C. 当b极有0.001molFe3+被还原时,则通过盐桥的电子数为0.001NA
D. 第二次指针偏转的原因是:I-浓度减小,反应逆向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯氧布洛芬具有良好的解热、镇痛、抗炎、抗风湿作用 ,苯氧布洛芬的合成路线:

回答下列问题:
(1)苯氧布洛芬中官能团的名称为____。
(2)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。A~D四种物质中,含有手性碳的有机物为____(填字母)。
(3)反应②的反应类型是____。
(4)若过程①发生的是取代反应,且另一种产物为HBr,由A生成B发生反应的化学方程式为____。
(5)有机物M与C互为同分异构体,M满足下列条件:
Ⅰ.能与FeCl3溶液发生显色反应,1 mol M可消耗2 mol NaOH;
Ⅱ.M分子中有6种不同化学环境的氢,核磁共振氢谱为3∶2∶2∶2∶2∶3,且分子中含有![]() 结构。
结构。
写出符合条件的M的一种结构简式:____。
(6)根据已有知识并结合相关信息,写出以丙酮(CH3COCH3)为原料制备2-甲基丙酸的合成路线流程图(无机试剂任用)。_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有如下3个热化学方程式:H2(g)+![]() O2(g)= H2O(g) △H=a kJ/mol,H2(g)+
O2(g)= H2O(g) △H=a kJ/mol,H2(g)+ ![]() O2(g)= H2O(l) △H=b kJ/mol,2H2(g) +
O2(g)= H2O(l) △H=b kJ/mol,2H2(g) + ![]() O2(g)= 2H2O(l) △H=c kJ/mol,关于它们的下列表述正确的是:
O2(g)= 2H2O(l) △H=c kJ/mol,关于它们的下列表述正确的是:
A.它们都是吸热反应B.a、b、c均为正值C.a=bD.c=2b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G具有镇痛、消炎等药理作用,其合成路线如下:
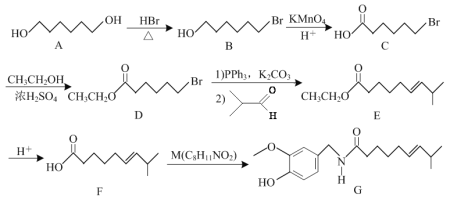
(1)E中官能团的名称为____、____。
(2)B→C、E→F的反应类型分别为____、____。
(3)M的结构简式为____。
(4)写出同时满足下列条件的C的一种同分异构体的结构简式:____。
Ⅰ.既能发生银镜反应,也能发生水解反应;
Ⅱ.与NaOH溶液共热后所得产物之一含三种化学环境不同的氢,且能与金属钠反应。
(5)请写出以乙烯、丙烯和PPh3为原料制备(CH3)2C=CH-CH=C(CH3)2的合成路线流程图(无机试剂任用,合成路线流程图例见本题题干)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一。
(1)若电解食盐水时消耗NaCl的质量为234 g,则在理论上最多可得氯气的体积为________升(标准状况)。
(2)若将2 mol的氯气通入足量石灰乳中,理论上可得到次氯酸钙________克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的重要化合物如氨(NH3)、肼(N2H4)、三氟化氮(NF3)等,在生产、生活中具有重要作用。
(1) 利用NH3的还原性可消除氮氧化物的污染,相关热化学方程式如下:
H2O(l)=H2O(g) △H1=44.0 kJ·mol-1
N2(g)+O2(g)=2NO(g) △H2=229.3 kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H3=-906.5 kJ·mol-1
4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H4
则△H4=_______kJ·mol-1。
(2)使用NaBH4为诱导剂,可使Co2+与肼在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体。
① 写出该反应的离子方程式:________。
② 在纳米钴的催化作用下,肼可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如下图1所示,则N2H4发生分解反应的化学方程式为:________;为抑制肼的分解,可采取的合理措施有________(任写一种)。
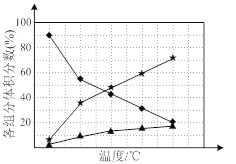
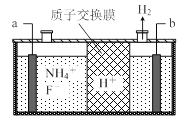
图1 图2
(3)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如上图2所示。
① 氮化硅的化学式为___________________。
② a电极为电解池的_____________(填“阴”或“阳”)极,写出该电极的电极反应式:________________;电解过程中还会生成少量氧化性极强的气体单质,该气体的分子式是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com