
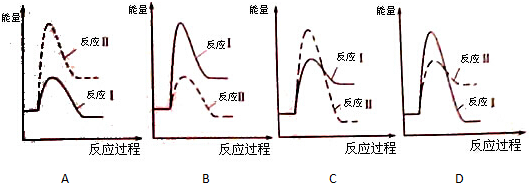
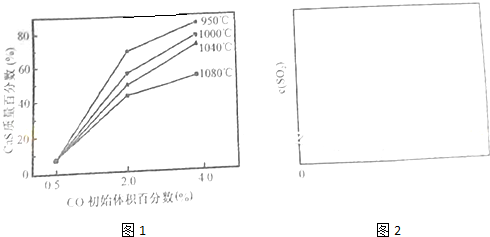
| p4(CO2) |
| p4(CO) |
| p4(CO2) |
| p4(CO) |
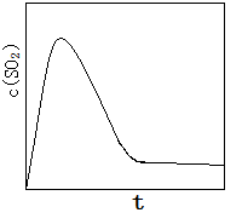 ,故答案为:
,故答案为: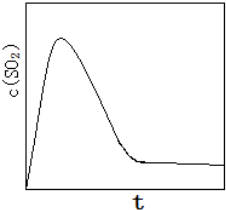 .
.


 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
| A、禁用含铅汽油是为了提高汽油的燃烧效率 |
| B、甲醇与乙醇是同系物,所以酒中含有甲醇是允许饮用的 |
| C、甲醛的水溶液可用于防腐,所以可以食用用甲醛浸泡过的动物内脏 |
| D、“白色污染”是指聚乙烯等塑料垃圾 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
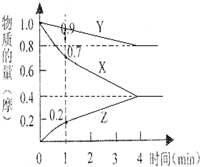 (1)某温度时,2L的密闭容器中X、Y、Z三种物质的物质的量随时间的变化如图所示.由图中数据分析,该反应的化学方程式为
(1)某温度时,2L的密闭容器中X、Y、Z三种物质的物质的量随时间的变化如图所示.由图中数据分析,该反应的化学方程式为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
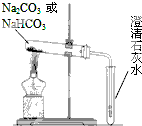 碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)都可作为食用碱.
碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)都可作为食用碱.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
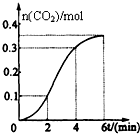
| A、反应开始2分钟内平均反应速率最大 |
| B、反应4分钟后平均反应速率最小 |
| C、反应开始4分钟内温度对反应速率的影响比浓度大 |
| D、反应4分钟后反应速率下降的原因是盐酸浓度逐渐减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com