
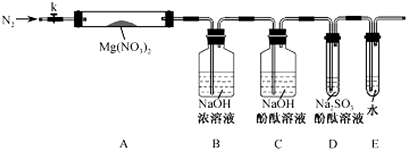
分析 (1)根据氧化还原反应化合价升降相等判断;
(2)①反应前检验装置的气密性;
②甲、乙、丙中都有氧气,避免空气中氧气干扰;根据加热试管的操作要求完成;
(3)①根据硝酸镁的反应现象进行判断;
②D中亚硫酸钠具有还原性,能够和氧气反应生成硫酸钠,溶液褪色;二氧化氮和氢氧化钠溶液反应生成一氧化氮,一氧化氮会消耗氧气.
解答 解:(1)由于产物中化合价只有降低情况,没有升高,不满足氧化还原反应的特征,
故答案为:不符合氧化还原反应原理(或其它合理答案);
(2)①实验前需要检验装置的气密性,方法是关闭k,微热硬质玻璃管(A),观察到E中有气泡连续放出,证明装置气密性良好,
故答案为:装置气密性良好;
②由于甲乙丙猜想中产物都有氧气,没有氮气,用氮气排出装置中空气避免对产物氧气检验的干扰,
集中加热前先预热硬质试管,然后固定在管中固体部位下加热,
故答案为:避免对产物O2检验产生干扰(或其它合理答案);移动酒精灯预热硬质玻璃管;
(3)①硝酸镁分解,红棕色气体是二氧化氮,镁元素不会还是硝酸镁形式,所以乙正确;
故答案为:乙;
②亚硫酸钠和氧气的反应,反应方程式是:2Na2SO3+O2=2Na2SO4,
在B装置中,二氧化氮和氢氧化钠溶液反应生成一氧化氮,生成的一氧化氮消耗了氧气,
故答案为:2Na2SO3+O2=2Na2SO4;O2在通过装置B时已参与反应(或其它合理答案).
点评 本题探究硝酸镁分解产物,提出假想,通过实验验证,涉及了化学方程式的书写、加热操作的考查,本题难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年江苏省高二上10月阶段测化学卷(解析版) 题型:选择题
下列说法中不正确的是
A.二氧化硫气体能用浓硫酸来干燥
B.胶体区别于其他分散系的本质特征是分散质粒子的直径不同
C.砖瓦、玻璃、水泥和石灰石的主要成分都属于硅酸盐
D.氨水、铵盐受热都易发生化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=7的溶液呈中性 | |
| B. | pH值为0的溶液中c(H+)=0 mol/L | |
| C. | pH=5的溶液中[H+]=1.0×10-5 mol•L-1 | |
| D. | pH=5的溶液中[OH-]=1.0×10-9 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液和盐酸;CO32-+2H+═H2O+CO2↑ | |
| B. | 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3═2FeO42-+3Cl-+H2O+4H+ | |
| C. | 向硫化钠溶液中滴入氯化铝溶液:2Al3++3S2-═Al2S3↓ | |
| D. |  溶液通入少量CO2: 溶液通入少量CO2: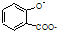 +CO2+H2O→ +CO2+H2O→ +HCO3- +HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑥ | B. | ①②③⑤ | C. | ①③⑤⑥ | D. | ③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
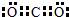 ,Z3+的原子结构示意图为
,Z3+的原子结构示意图为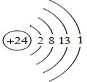
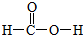 ,m g该物质完全燃烧后通过足量Na2O2固体吸收,Na2O2固体增重的质量为$\frac{15m}{23}$g.
,m g该物质完全燃烧后通过足量Na2O2固体吸收,Na2O2固体增重的质量为$\frac{15m}{23}$g.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
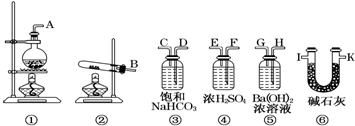
 某研究小组为探究SO2和Fe(NO3)3溶液的反应的实质.设计了如图所示装置进行实验.已知:1.0mol/L的Fe(NO3)3溶液的pH=1.
某研究小组为探究SO2和Fe(NO3)3溶液的反应的实质.设计了如图所示装置进行实验.已知:1.0mol/L的Fe(NO3)3溶液的pH=1.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
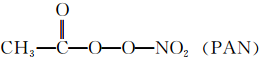 等二次污染物.
等二次污染物.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com