
阿斯匹林结构简式为
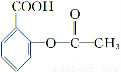
它可以发生的反应类型正确的组合是( )
①取代反应 ②加成反应 ③水解反应
A.①② B.①③ C.②③ D.全部
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题12有机物的结构与性质练习卷(解析版) 题型:选择题
维生素C是人体维持正常生命过程所必需的一种物质,主要来源于新鲜的蔬菜和水果中,其结构如图所示。下列关于维生素C的说法中正确的是( )
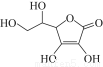
A.属于有机物,难溶于水,易溶于有机溶剂
B.能使FeCl3溶液显紫色
C.能使溴的四氯化碳溶液褪色
D.在一定条件下,能发生加成反应和氧化反应,但不能发生水解反应
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题四氧化还原反应练习卷(解析版) 题型:选择题
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对生态系统造成很大的损害,其中还原沉淀法是常用的一种处理方法。流程如下:
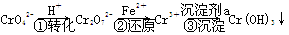
其中第①步中存在平衡:2CrO42- (黄色)+2H+??Cr2O72- (橙色)+H2O。下列有关说法正确的是( )
A.第①步当2v(Cr2O72-)=v(CrO42-)时,达到了平衡状态
B.对于上述平衡,加入适量稀硫酸后,溶液颜色变黄色,则有利于CrO42-的生成
C.第②步中,还原0.1 mol Cr2O72-需要45.6 g FeSO4
D.第③步沉淀剂a可以使用NaOH等碱性物质
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十四常见有机物及其应用练习卷(解析版) 题型:选择题
下列说法正确的是( )
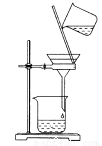
A.分离乙醇和乙酸乙酯的混合物,所用玻璃仪器为分液漏斗、烧杯
B.用如图所示装置分离CCl4萃取碘水后已分层的有机层和水层
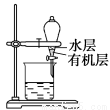
C.用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出
D.用如图所示装置除去乙醇中的苯酚
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十四常见有机物及其应用练习卷(解析版) 题型:选择题
甲、乙、丙、丁四支试管,甲、丁中均盛有1 mL的稀酸性KMnO4溶液,乙、丙中分别盛有2 mL溴水+2 g FeBr3、2 mL Br2的CCl4溶液+2 g FeBr3,再向甲、乙中加入适量苯,丙、丁中加入适量的甲苯,充分振荡后静置。下列有关分析中正确的一组是( )
选项甲乙丙丁
A溶液不褪色发生取代反应发生取代反应溶液褪色
B水层不褪色分层,上层呈红棕色溶液褪色甲苯被氧化
C溶液褪色分层,上层呈红棕色无明显变化甲苯被氧化
D分层,下层呈紫红色无明显变化有难溶性油状液体析出无明显变化
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十六物质结构与性质练习卷(解析版) 题型:填空题
现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A原子核外电子分占3个不同能级,且每个能级上排布的电子数相同
B元素原子的核外p电子总数比s电子总数少1
C原子p轨道上成对电子数等于未成对电子数,且与A同周期
D元素的族序数与周期数的差为4,且不与A元素在同一周期
E位于周期表中第七列
F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子
(1)A的基态原子最外层有______种不同运动状态的电子。
(2)E2+的基态核外电子排布式为____________________。
(3)A、B、C三种元素的最简单氢化物的熔点由低到高的顺序是________。A、B、C三种元素组成的分子中与AC2互为等电子体的分子为________________(用元素符号表示)。
(4)BD3中心原子的杂化方式为________,其分子空间构型为____________。
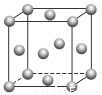
(5)用晶体的X射线衍射法对F的测定得到以下结果:F的晶胞为面心立方最密堆积(如下图),又知该晶体的密度为ρ g·cm-3,晶胞中该原子的配位数为______________;F的原子半径是________ cm(阿伏加德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十五综合实验探究练习卷(解析版) 题型:实验题
3,5?二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成。一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5?二甲氧基苯酚的部分物理性质见下表:
物质 | 沸点/℃ | 熔点/℃ | 密度(20 ℃) /g·cm-3 | 溶解性 |
甲醇 | 64.7 | — | 0.791 5 | 易溶于水 |
乙醚 | 34.5 | — | 0.713 8 | 微溶于水 |
3,5?二甲氧基苯酚 | — | 33~36 | — | 易溶于甲醇、乙醚,微溶于水 |
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取。①分离出甲醇的操作是________________。②萃取用到的分液漏斗使用前需________并洗净,分液时有机层在分液漏斗的________(填“上”或“下”)层。
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤。用饱和NaHCO3溶液洗涤的目的是________;用饱和食盐水洗涤的目的是________________________。
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是________(填字母)。
a.蒸馏除去乙醚 b.重结晶
c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤。为了防止倒吸,减压过滤完成后应先________,再________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十三无机化学综合应用练习卷(解析版) 题型:填空题
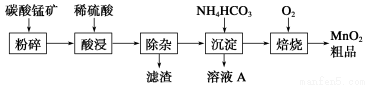
工业上以碳酸锰矿为主要原料生产MnO2的工艺流程如下:
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Pb(OH)2 | Mn(OH)2 |
开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 | 8.0 | 8.3 |
沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.8 | 9.8 |
请回答下列问题:
(1)酸浸前将碳酸锰矿粉碎的作用是__________________。
(2)酸浸后的溶液中含有Mn2+、SO42—,另含有少量Fe2+、Fe3+、Al3+、Cu2+、Pb2+等,其除杂过程如下:
①加入MnO2将Fe2+氧化,其离子反应方程式为__________________________。
②加入CaO将溶液的pH调到5.2~6.0,其主要目的是
_____________________________________________________________。
③加入BaS,除去Cu2+、Pb2+后,再加入NaF溶液,除去______________________。
(3)从溶液A中回收的主要物质是________________,该物质常用作化肥。
(4)MnO2粗品中含有少量Mn3O4,可以用稀硫酸处理,将其转化为MnSO4和MnO2,然后再用氧化剂将Mn2+转化为MnO2,制得优质MnO2。写出Mn3O4与稀硫酸反应的化学方程式:______________________________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题八电化学练习卷(解析版) 题型:填空题
以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎。
Ⅱ.采用如下装置进行电化学浸出实验
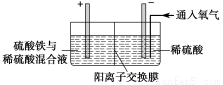
将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。
Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:2RH(有机相)+Cu2+(水相)  R2Cu(有机相)+2H+(水相)
R2Cu(有机相)+2H+(水相)
分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。
Ⅳ.电解硫酸铜溶液制得金属铜。
(1)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2+4H+=Cu2++Fe2++2H2S
2Fe3++H2S=2Fe2++S↓+2H+
①阳极区硫酸铁的主要作用是____________。
②电解过程中,阳极区Fe3+的浓度基本保持不变,原因是______________________。
(2)阴极区,电极上开始时有大量气泡产生,后有固体析出,一段时间后固体溶解。写出上述现象对应的反应式____________________。
(3)若在实验室进行步骤Ⅲ,分离有机相和水相的主要实验仪器是__________;加入有机萃取剂的目的是__________。
(4)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是____________。
(5)步骤Ⅳ,若电解200 mL 0.5 mol·L-1的CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com