
| A. | C和O2 | B. | Na2CO3和盐酸 | C. | Na和O2 | D. | NaHCO3和NaOH |
分析 A.碳与氧气反应可生成二氧化碳或一氧化碳;
B.Na2CO3和盐酸可生成碳酸氢钠、二氧化碳;
C.钠和氧气反应可生成氧化钠、过氧化钠;
D.NaHCO3和NaOH反应生成碳酸钠和水.
解答 解:A.碳与氧气反应,氧气少量生成一氧化碳,氧气过量生成二氧化碳,反应物用量对生成物有影响,故A不选;
B.Na2CO3溶液与HCl反应盐酸量不同可以生成碳酸钠或碳酸氢钠,改变反应条件或反应物的用量对生成物的种类有影响,故B不选;
C.Na与O2在不加热时生成Na2O,加热时生成Na2O2,反应条件不同,生成物不同,故C不选;
D.NaHCO3和NaOH反应生成碳酸钠和水,与反应条件和量无关,故D选.
故选D.
点评 本题主要考查元素化合物知识,为高频考点,侧重于学生的分析能力的考查,题目难度不大,本题注意常见元素化合物知识,注重相关知识的积累.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
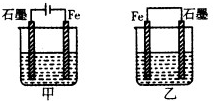 如图所示装置,均盛有等体积等浓度的稀硫酸,工作一段时间后当甲乙装置中通过电子的物质的量相同时,下列说法正确的是( )
如图所示装置,均盛有等体积等浓度的稀硫酸,工作一段时间后当甲乙装置中通过电子的物质的量相同时,下列说法正确的是( )| A. | A、甲乙两装置中的石墨电极分别是阴极、负极 | |
| B. | 铁棒的腐蚀程度:甲>乙 | |
| C. | 石墨电极上发生反应的电极反应式相同 | |
| D. | 溶液的pH:甲减小,乙增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ClO3->BrO3->Cl2>Fe3+>I2 | B. | BrO3->Cl 2>ClO3->I2>Fe3+ | ||
| C. | BrO3->ClO3->Cl2>Fe3+>I2 | D. | BrO3->ClO3->Fe3+>Cl2>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
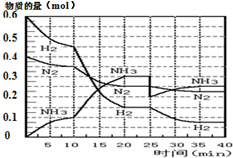 氨的合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ•mol-1.现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图.
氨的合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ•mol-1.现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图.| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 200ml 0.1mol/LFeCl3溶液 | B. | 100ml 0.1mol/L MgCl2溶液 | ||
| C. | 200ml 0.1mol/L NaCl溶液 | D. | 100ml 0.4mol/L BaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ③ | C. | ①②③ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v1、v2、K1、K2同时增大 | B. | v1、v2、K1、K2同时减小 | ||
| C. | v1、v2增大,K1增大,K2减小 | D. | v2减小,v1增大,K1增大,K2减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在一定条件下,反应CO(g)+2H2(g)?CH3OH(g)在一密闭容器中达到平衡,充入适量氢气,增大容器的体积,维持H2的浓度和容器的温度不变,原平衡相比较达新平衡时CO的转化率不变 | |
| B. | 常温下:pH=12的NaOH溶液和pH=2的醋酸混合后恰好完全反应(不考虑溶液体积的变化),反应后的溶液中:c(CH3COO-)+c(CH3COOH)=0.01mol/L | |
| C. | pH相同的①CH3COONa;②NaHCO3;③NaAlO2三份溶液中的c(Na+):③>②>① | |
| D. | 已知某温度下:Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12,将0.001mol/L的AgNO3溶液逐滴滴入0.001mol/L的KCl和0.001mol/L K2CrO4溶液,则先产生Ag2CrO4沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com