汽车尾气净化中的一个反应如下:2NO(g)+2CO(g)?N
2(g)+2CO
2(g)
请回答下列问题:
(1)已知:N
2(g)+O
2(g)=2NO(g);△H=+180.5kJ/mol
C(s)+O
2(g)=CO
2(g);△H=-393.5kJ/mol
2C(s)+O
2(g)=2CO(g);△H=-221kJ/mol
则2NO(g)+2CO(g)?N
2(g)+2CO
2(g)的△H=
.
(2)在一定温度下,在一体积为V升的密闭容器中充入一定量的NO和CO
2在t
1时刻达到平衡状态,此时n(CO)=a mol,n(NO)=2a mol,n(N
2)=b mol,且N
2占平衡总体积的
.
①则该反应的平衡常数K=
.(用只含a、V的式子表示)
②判断该反应达到平衡的标志是
A.v生成(CO
2)=v消耗(CO)
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
D.NO、CO、N
2、CO
2的浓度均不再变化
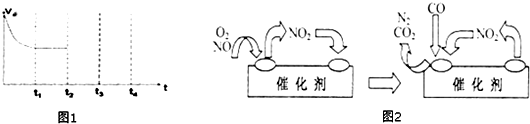
③在t
2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t
3时刻达到新的平衡状态.请在图1中补充画出从t
2到t
4时刻正反应速率随时间的变化曲线:
(3)如果要净化汽车尾气同时提高该反应的速率和NO的转化率,采取的措施是
A.降低温度
B.增大压强同时加催化剂
C.升高温度同时充入N
2 D.及时将CO
2和N
2从反应体系中移走
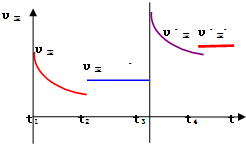
(4)为避免汽车尾气中的有害气体对大气的污染,给汽车安装尾气净化装置.净化装置里装有含Pd等过渡元素的催化剂,气体在催化剂表面吸附与解吸作用的机理如图2所示.
①写出此变化中的总化学反应方程式:
.
②有人提出,可以设计反应2CO(g)=2C(s)+O
2(g)来消除CO的污染.请你判断是否可行并说出理由:
.


 ,故答案为:
,故答案为: ;
;

 分子中所有碳原子不可能在同一直线上
分子中所有碳原子不可能在同一直线上 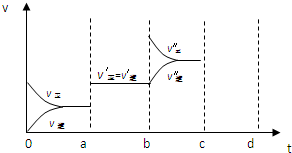 在25℃时,2L的密闭容器中A、B、C三种气体的初始浓度和平衡浓度如下表:
在25℃时,2L的密闭容器中A、B、C三种气体的初始浓度和平衡浓度如下表: