
【题目】(1)常温下将0.01molNH4Cl和0.002molNaOH溶于水配成1L溶液。
①该溶液中除H2O的电离平衡外还存在的平衡体系是___。
②溶液中共有___种不同的微粒。
③这些粒子中浓度为0.01mol·L-1的是___,浓度为0.002mol·L-1的是___。
④物质的量之和为0.01mol的两种微粒是___。
(2)某二元酸(化学式用H2B表示)在水中的电离方程式是H2B=H++HB-;HB-![]() H++B2-,回答下列问题:
H++B2-,回答下列问题:
①已知0.1mol·L-1NaHB溶液的pH=2,则0.1mol·L-1H2B溶液中c(H+)___(填“<”、“>”、“=”)0.11mol·L-1理由是___。
②0.1mol·L-1NaHB溶液中各种离子浓度由大到小的顺序是___。
【答案】NH3·H2O![]() NH4++OH-,NH4++H2O
NH4++OH-,NH4++H2O![]() NH3·H2O+H+ 7 Cl- Na+ NH4+、NH3·H2O < H2B第一步电离产生的H+对HB-的电离起了抑制作用 c(Na+)>c(HB-)>c(H+)>c(B2-)>c(OH-)
NH3·H2O+H+ 7 Cl- Na+ NH4+、NH3·H2O < H2B第一步电离产生的H+对HB-的电离起了抑制作用 c(Na+)>c(HB-)>c(H+)>c(B2-)>c(OH-)
【解析】
0.01molNH4Cl和0.002molNaOH按物质的量比1:1进行反应生成一水合氨和氯化钠,反应的定量关系可知氯化铵过量,溶液中溶质为NH3H2O、NaCl、NH4Cl;由H2B在水中的电离方程式H2B=H++HB-;HB-![]() H++B2-可知,第一步完全电离、第二步部分电离。
H++B2-可知,第一步完全电离、第二步部分电离。
(1)①氯化铵和氢氧化钠反应生成一水合氨和氯化钠,氯化铵过量,故溶液中存在一水合氨的电离平衡,铵根离子水解平衡以及水的电离平衡:NH3·H2O![]() NH4++OH-,NH4++H2O
NH4++OH-,NH4++H2O![]() NH3·H2O+H+,H2O
NH3·H2O+H+,H2O![]() H++OH-。
H++OH-。
②溶液中溶质为NH3H2O、NaCl、NH4Cl,溶液中存在钠离子、氯离子、铵根离子、氢氧根离子、氢离子、一水合氨分子、水分子,共有7种不同的微粒。
③因为平衡体系的存在,微粒中只要钠离子、氯离子在溶液中不发生变化,这些微粒中浓度为0.01mol/L的是Cl-,浓度为0.002mol/L的是Na+。
④物料守恒分析,0.01molNH4Cl和0.002molNaOH溶于水配成1L溶液,则溶液中存在的氮元素物质的量一定为0.01mol,铵根离子结合氢氧根离子生成一水合氨,一水合氨电离生成铵根离子和氢氧根离子,根据物料守恒可知,氮元素的存在形式为NH4+、NH3H2O,则物质的量之和为0.01mol的两种微粒是NH4+、NH3H2O。
(2)①因为0.1mol·L-1NaHB溶液的pH=2,则0.1mol·L-1HB-电离出的氢离子的浓度为0.01 mol·L-1,0.1mol·L-1H2B溶液中,H2B=H++HB-电离出0.1mol·L-1氢离子和0.1mol·L-1 HB-,但H2B=H++HB-电离出的H+对HB-的电离起了抑制作用,故0.1mol·L-1H2B溶液中c(H+)<0.11mol·L-1。
②0.1mol·L-1NaHB溶液中存在HB-![]() H++B2-,故
H++B2-,故


科目:高中化学 来源: 题型:
【题目】央视焦点访谈节目曾报道,俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌。“一滴香”的分子结构如下图所示,下列说法正确的是( )
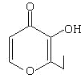
A.该有机物的分子式为C7H6O3
B.1mol该有机物最多能与2molH2发生加成反应
C.该有机物的一种芳香族同分异构体能发生银镜反应
D.该有机物能发生取代、加成、氧化和还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以淀粉为基本原料制备聚乙烯和乙酸。下列说法正确的是( )
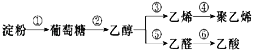
A.淀粉和葡萄糖都是营养物质,均能在体内发生水解、氧化反应
B.工业上以石油为原料制取聚乙烯,需经裂解、加聚等反应
C.燃烧等物质的量的乙烯和乙醇耗氧量不同
D.乙醇和乙酸发生酯化反应制乙酸乙酯,原子利用率为100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验探究小组研究320K时![]() 的分解反应:
的分解反应:![]() 。如图是该小组根据所给表格中的实验数据绘制的。下列有关说法正确的是( )
。如图是该小组根据所给表格中的实验数据绘制的。下列有关说法正确的是( )
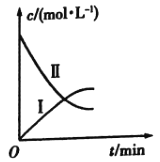
t/min | 0 | 1 | 2 | 3 | 4 |
| 0.160 | 0.114 | 0.080 | 0.056 | 0.040 |
| 0 | 0.023 | 0.040 | 0.052 | 0.060 |
A.曲线Ⅰ是![]() 的浓度变化曲线
的浓度变化曲线
B.曲线Ⅱ是![]() 的浓度变化曲线
的浓度变化曲线
C.![]() 的浓度越大,反应速率越快
的浓度越大,反应速率越快
D.![]() 的浓度越大,反应速率越快
的浓度越大,反应速率越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】公元八世纪,Jabir ibn Hayyan在干馏硝石的过程中首次发现并制得硝酸(4KNO3![]() 2K2O+4NO↑+3O2↑),同时他也是硫酸和王水的发现者。下列说法正确的是
2K2O+4NO↑+3O2↑),同时他也是硫酸和王水的发现者。下列说法正确的是
A. 干馏产生的混合气体理论上可被水完全吸收
B. 王水是由3体积浓硝酸与1体积浓盐酸配制而成的
C. 王水溶解金时,其中的盐酸作氧化剂(Au+HNO3+4HCl=H[AuCl4]+NO↑+2H2O)
D. 实验室可用NaNO3与浓硫酸反应制备少量的HNO3,利用的是浓硫酸的氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室在临时配制一些FeCl2的溶液时,常将氯化亚铁固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,是为了_____________。稀释后还需要加入一些铁粉,其目的是____________,相关反应的离子方程式为__________________。
(2)氯化铁水溶液呈___________性,原因是(用离子方程式表示):________。把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是________。如果要从氯化铁溶液得到纯氯化铁固体,常采用的方法是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率和限度的说法中,不正确的是( )
A. 已知工业合成氨的正反应方向放热,所以升温正反应速率降低,逆反应速率升高
B. 实验室用H2O2分解制备O2,加入MnO2后,反应速率明显加快
C. 2SO2+O2![]() 2SO3反应中,SO2的转化率不能达到100%
2SO3反应中,SO2的转化率不能达到100%
D. 实验室用碳酸钙和盐酸反应制取CO2,用碳酸钙粉末比块状反应要快
查看答案和解析>>
科目:高中化学 来源: 题型:
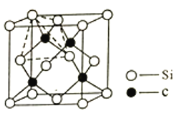
【题目】非金属元素虽然种类不多,但是在自然界中的丰度却很大,请回答下列问题:
(1)BN(氮化硼,晶胞结构如图)和CO2中的化学键均为共价键,BN的熔点高且硬度大,CO2的晶体干冰却松软且极易升华。由此可以判断:BN可能是______晶体,CO2可能是______晶体,BN 晶体中B原子的杂化轨道类型为______,干冰中C原子的杂化轨道类型为______

(2)分子极性:OF2______H2O,键角:OF2______H2O(填“>””或者“<”)
(3)金刚石和石墨都是碳元素的单质,但石墨晶体熔点比金刚石______,原因是______
(4)单晶硅的结构与金刚石结构相似,若将金刚石晶体中一半的C原子换成Si原子且同种原子不成键,则得如图所示的金刚砂(SiC)结构。在SiC结构中,每个C原子周围距离相等且最近的C原子数目为______,假设C-Si键长为acm,则晶胞密度为______g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图为干冰的晶体结构示意图。
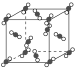
通过观察分析,每个CO2分子周围紧邻等距离的CO2分子有__个。将CO2分子视作质点,设晶胞边长为apm,则紧邻的两个CO2分子的距离为__pm。
(2)在冰晶体中,水分子之间的主要作用力是__,还有__,由于该主要作用力与共价键一样具有__性,故1个水分子周围只有__个紧邻的水分子,这些水分子位于__的顶点。这种排列方式使冰晶体中水分子的空间利用率__(填“较高”或“较低”),故冰的密度比水的密度要__(填“大”或“小”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com