
| A、.将少量金属钠放入冷水中:Na+2H2O=Na++2OH-+H2↑ | ||||
| B、向氯化铁溶液中加入铜:2Fe3++3Cu=2Fe+3Cu2+ | ||||
| C、向氯化铝溶液中加入过量氨水:Al3++4NH3?H2O=[Al(OH)4]--+4NH4+ | ||||
D、向二氧化锰中滴加浓盐酸并加热:MnO2+4H++2Cl-
|
| ||


科目:高中化学 来源: 题型:
| A、CO32-、Na+、SO42-、H+ |
| B、Cu2+、SO42-、H+、Cl- |
| C、K+、OH-、NO3-、HCO3- |
| D、Al3+、NO3-、SO42-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、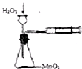 定量测定化学反应速率 |
B、 验证钠与水反映的热效应 |
C、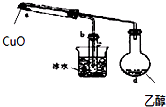 加热d即可进行乙醇的催化氧化实验 |
D、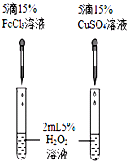 比较Fe3+和Cu2+对H2O2分解的催化效果 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③②④ | B、①③④② |
| C、①③②⑤ | D、①④③② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、500mL 1mol?L-1 MgCl2溶液中含有Cl-数目为0.5NA |
| B、标准状况下,1mol H2O与1mol O2所占的体积相等 |
| C、1mol S与足量Cu反应生成Cu2S,转移的电子数为NA |
| D、常温常压下,1mol氦气所含的原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (物质结构与性质)磷化硼(BP)和氮化硼(BN)是受到高度关注的耐磨涂料,它们的结构相似,右下图为磷化硼晶体结构中最小的重复结构单元.磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成:BBr3+PBr3+3H2=BP+6HBr.
(物质结构与性质)磷化硼(BP)和氮化硼(BN)是受到高度关注的耐磨涂料,它们的结构相似,右下图为磷化硼晶体结构中最小的重复结构单元.磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成:BBr3+PBr3+3H2=BP+6HBr.查看答案和解析>>
科目:高中化学 来源: 题型:
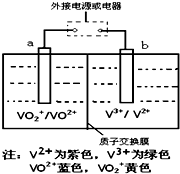 (1)北京奥运会的“祥云”火炬所用燃料主要是丙烷,若以硫酸溶液为电解质溶液,两极分别通入丙烷和空气,形成燃料电池,则反应总方程式为
(1)北京奥运会的“祥云”火炬所用燃料主要是丙烷,若以硫酸溶液为电解质溶液,两极分别通入丙烷和空气,形成燃料电池,则反应总方程式为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com