
【题目】某同学将一小块金属钠置于表面皿上,并露置于空气中,观察到下列现象:
银白色![]() 变灰暗
变灰暗![]() 变白
变白![]() 表面出现液滴
表面出现液滴![]() 白色固体
白色固体![]() 白色粉末,下列说法正确的是( )
白色粉末,下列说法正确的是( )
A.过程①钠转化为过氧化钠
B.过程③是碳酸钠吸收空气中的水蒸气形成溶液
C.过程④只发生了物理变化
D.如果时间足够长,最后得到的白色粉末是Na2CO3
【答案】D
【解析】
银白色金属钠在空气中被氧气氧化,生成白色固体Na2O,颜色变暗,生成的Na2O与空气中的水分结合生成氢氧化钠,表面变白,氢氧化钠潮解,表面出现了液滴,氢氧化钠继续与空气中的CO2反应生成碳酸钠晶体,失水后变为白色粉末,据此分析判断。
A. 过程①钠与氧气常温下反应,生成了白色固体氧化钠,A项错误;
B. 过程③是生成的Na2O与空气中的水分结合生成氢氧化钠,表面变白,氢氧化钠潮解,表面出现了液滴,B项错误;
C. 过程④氢氧化钠继续与空气中的CO2反应生成碳酸钠晶体,发生了化学变化,C项错误;
D. 如果时间足够长,碳酸钠晶体失水,最后得到的白色粉末是Na2CO3,D项正确;
答案选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】美国康乃尔大学的威考克斯(C·Wilcox)所合成的一种有机分子就像一尊释迦牟尼佛像,因而称为释迦牟尼分子(分子中所有原子均在同一平面)如图。对于该有机物的叙述正确的是
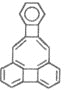
①该有机物属于芳香烃;②该有机物的分子式为C22H12; ③该有机物能发生加成反应;④该有机物的一氯代物的同分异构体有6种
A. ①③④B. ①②C. ②③D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaBH4燃料电池具有理论电压高、能量密度大等优点。以该燃料电池为电源电解精炼铜的装置如图所示。下列说法不正确的是
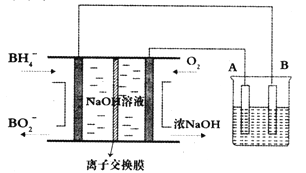
A. 离子交换膜应为阳离子交换膜,Na+由左极室向右极室迁移
B. 该燃料电池的负极反应式为BH4-+8OH--8e-=BO2-+6H2O
C. 电解池中的电解质溶液可以选择CuSO4溶液
D. 每消耗2.24LO2(标准状况)时,A电极的质量减轻12.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锶(Sr)为第5周期ⅡA族元素。高纯六水氯化锶晶体(SrCl2·6H2O)具有很高的经济价值,61℃时晶体开始失去结晶水,100℃时失去全部结晶水。用工业碳酸锶粉末(含少量Ba、Fe的化合物等杂质)制备高纯六水氯化锶晶体的过程如下图所示。
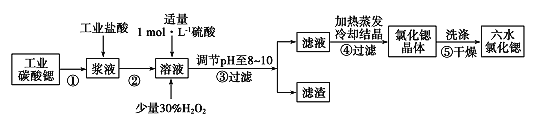
请回答:
(1)常温下,氯化锶溶液pH____7(已知金属性Ca<Sr)(填“大于”、“等于”或“小于”);
(2)写出在浆液中加入盐酸时主要发生的离子方程式________;
(3)步骤③所得滤渣的主要成分是______(填化学式),调节溶液pH至8~10,宜选用的试剂为 ______。
A.稀硫酸 B.氢氧化锶粉末 C.氢氧化钠 D.氧化锶粉末
(4)步骤⑤中,洗涤氯化锶晶体最好选用____。
A.水 B.稀硫酸 C.氢氧化钠溶液 D.氯化锶饱和溶液
(5)工业上用热风吹干六水氯化锶,选择的适宜温度范围是____(填字母)。
A.50~60℃ B.70~80℃ C.80~100℃ D.100℃以上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知32gA与40gB恰好完全反应,生成mgC和9gD。在相同条件下,16gA和30gB混合反应生成0.25molC及若干摩尔D,则物质C的摩尔质量应是( )
A.63g/molB.122g/molC.126g/molD.163g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述中正确的是( )
A.1 mol NaCl中含有NaCl分子数为NA
B.室温下,1 L pH=13的NaOH溶液中,由水电离的OH-数目为0.1NA
C.1 mol Fe高温条件下与水蒸气反应,电子转移数为3NA
D.12 g石墨烯(单层石墨)中含有六元环的个数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组利用二氧化锰与浓盐酸反应制取纯净、干燥的氯气,装置如下图所示:
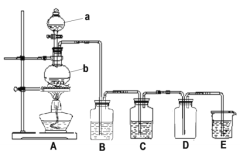
请回答下列问题:
(1)a装置的名称___________________________;
(2)收集氯气的方法为___________________________;
(3)烧瓶中发生反应的化学方程式为______________________;
(4)装置B中饱和食盐水的作用是_____________,装置E的作用是_________________;
(5)取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为6.72L。则参加反应的二氧化锰的质量为______,参加反应的HCl的物质的量为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组模拟工业上用SiHCl3与H2在1357 K的条件下制备高纯硅,实验装置如下图所示 (加热及夹持装置略去):(SiHCl3相对分子质量为:135.5)
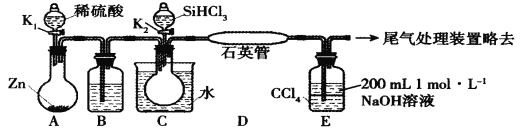
已知SiHCl3的性质如下:沸点为33.0℃;密度为1.34 g·mL-1;易溶于有机溶剂;能与H2O剧烈反应;在空气中易被氧化。请回答:
(1)装置C中的烧瓶用水浴加热的优点为_____________________。
(2)装置D中发生反应的化学方程式为_____________________。
(3)装置E的作用为___________________。
(4)相关实验步骤如下,其合理顺序为_______________ (填序号)。
①加热装置C,打开K2,滴加6.5 mL SiHCl3;
②打开K1,装置A中反应一段时间;
③关闭K1; ④关闭K2; ⑤加热装置D至1357 K。
(5)计算SiHCl3的利用率:对装置E中液体进行分液操作,取上层液体20.00 mL转移至锥形瓶中,滴加几滴酚酞溶液。用0.1 mol·L-1盐酸滴定,达到滴定终点时,消耗盐酸20.00 mL。达到滴定终点的现象是____________。SiHCl3的利用率为__________%(保留两位小数)。
(6)设计实验,检验SiHCl3与水反应后,所得溶液中存在盐酸___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾天气严重影响人们的生活和健康。其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等。因此改善能源结构、机动车限号等措施能有效减少PM2.5、SO2、NOx等污染。请回答下列问题:
(1)汽车尾气中NOx和CO的生成:已知汽缸中生成NO的反应为:N2(g)+O2(g)2NO(g)—Q。恒温、恒容密闭容器中,下列说法中,能说明该反应达到化学平衡状态的是____________。
A.混合气体的密度不再变化
B.混合气体的压强不再变化
C.N2、O2、NO的物质的量之比为1∶1∶2
D.氧气的转化率不再变化
(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究性小组在实验室以Ag—ZSM—5为催化剂,测得NO转化为N2的转化率随温度变化情况如图所示。若不使用CO,温度超过775 K,发现NO的分解率降低,其可能的原因为______,在![]() =1的条件下,为更好的除去NOx,应控制的最佳温度在_______K左右。
=1的条件下,为更好的除去NOx,应控制的最佳温度在_______K左右。
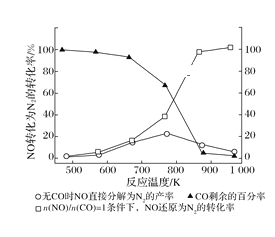
(3)车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”。活性炭可处理大气污染物NO。在5L密闭容器中加入NO和活性炭(假设无杂质),一定条件下生成气体E和F。当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如下表:
活性炭 | NO | E | F | |
初始 | 3.000 | 0.10 | 0 | 0 |
T1 | 2.960 | 0.020 | 0.040 | 0.040 |
T2 | 2.975 | 0.050 | 0.025 | 0.025 |
①若T1<T2,则该反应的△H _________ 0(填“>”“<”或“=”)。
②上述反应T1℃时达到化学平衡后再通入0.10molNO气体,则达到新化学平衡时NO的总转化率为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com