
| 800℃ |
| 序号 | 1 | 2 | 3 | 4 | 5 | 6 |
| n(O2)的量 | a=4 | (3) | A≥5.5 | |||
| 残留固体 中含铜物质 | CuFeS2 Cu2S | (2) | Cu Cu2S | Cu | Cu Cu2O | |
| 物质的量 分别是多少 | (1) | (4) |
| 800℃ |
| 800℃ |
| 800℃ |
| 800℃ |
| 15 |
| 6 |
| 800℃ |
| 11 |
| 4 |
| 800℃ |
| 800℃ |
| 1 |
| 4 |
| 800℃ |
| 800℃ |
| 15 |
| 6 |
| 800℃ |
| 11 |
| 4 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、阴极:2H++2e-=H2↑ 阳极:4OH--4e-=2H2O+O2↑ |
| B、阴极:2H++2e-=H2↑ 阳极:2Cl--2e-=Cl2↑ |
| C、阴极:Cu2++2e-=Cu 阳极:4OH--4e-=2H2O+O2↑ |
| D、阴极:Cu2++2e-=Cu 阳极:2Cl--2e-=Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、购物时自带环保购物袋或竹篮 |
| B、大力发展清洁能源,如太阳能、氢能、风能等等 |
| C、出门尽量步行或者乘坐公交车,少开私家车 |
| D、随意丢弃废旧电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:
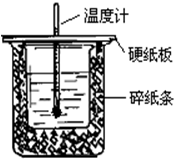 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②⑥ | B、④⑤ |
| C、③④⑦ | D、③④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O |
| B、向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
| C、大理石溶于醋酸溶液:CaCO3+2H+═Ca2++CO2↑+H2O |
| D、向明矾(KAl(SO4)2?12H2O)溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C15H27COOH |
| B、C15H31COOH |
| C、C17H31COOH |
| D、C17H33COOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com