
 已知X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大,元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y2是空气主要成分之一.请回答:
已知X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大,元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y2是空气主要成分之一.请回答:
分析 X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大,元素Z在地壳中含量最高,则Z为O元素;J元素的焰色反应呈黄色,则J为Na;Q的最外层电子数与其电子总数比为3:8,原子序数大于Na元素,故Q处于第三周期,则Q为S元素;X能与J形成离子化合物,且J+的半径大于X-的半径,可推知X为H元素;Y2是空气主要成分之一,则Y为N元素.
(1)主族元素周期数=电子层数、主族族序数=最外层电子数;X与J形成的离子化合物为NaH,由钠离子与氢负离子构成;
(2)同主族自上而下非金属性减弱,可利用气态氢化物的稳定性、单质之间的置换反应来、元素相互化合时化合价等说明,物质状态属于物理性质,不能比较非金属性强弱;
(3)X与Y可形成阳离子A为NH4+,先由铵盐与碱反应生成氨气,再利用氨气使湿润的红色石蕊试纸变蓝检验;
(4)Y的气态氢化物为NH3,与氧气发生催化氧化生成NO与水;
(5)负极上Na失去电子,正极上硫得电子发生还原反应,熔融状态下,Na2O和Al2O3能电离出阴阳离子而使电解质导电,且钠易和硫反应,所以它起到隔离作用,本质是Na与硫反应生成Na与硫形成的化合物,可以传导钠离子;
(6)常温下向1000mL 0.2mol/L的H2S的气态氢化物水溶液中加入1.15g的Na的单质,Na的物质的量为$\frac{1.15g}{23g/mol}$=0.05mol,生成NaOH为0.05mol,H2S的物质的量为1L×0.2mol=0.2mol,发生反应:NaOH+H2S=NaHS+H2O,生成0.05mol NaHS,剩余H2S为0.2mol-0.05mol=0.15mol,为NaHS、H2S混合溶液.反应后溶液中由水电离的氢离子浓度为1×10-9<1×10-7,说明水的电离被抑制,则H2S电离程度大于HS-的水解程度,溶液呈酸性,由水电离得到氢氧根离子浓度1×10-9,则溶液中氢离子浓度为1×10-5,H2S的电离程度很小,溶液中氢离子源于水的电离、硫化氢电离、硫氢根离子电离.
解答 解:X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大,元素Z在地壳中含量最高,则Z为O元素;J元素的焰色反应呈黄色,则J为Na;Q的最外层电子数与其电子总数比为3:8,原子序数大于Na元素,故Q处于第三周期,则Q为S元素;X能与J形成离子化合物,且J+的半径大于X-的半径,可推知X为H元素;Y2是空气主要成分之一,则Y为N元素.
(1)Q为S元素,原子核外有3个电子层、最外层电子数为6,处于周期表中第三周期ⅥA族,X与J形成的离子化合物为NaH,由钠离子与氢负离子构成,电子式为: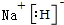 ,
,
故答案为:第三周期ⅥA族;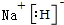 ;
;
(2)O、S同主族自上而下非金属性减弱,故非金属性O>S;
A.H2S的水溶液放置在空气中会变浑浊,说明氧气能氧化硫化氢生成硫,则氧气的氧化性大于S,说明O元素非金属较强,故A正确;
B.S与O元素形成的化合物中S元素表现正化合价,O元素表现负化合价,氧原子对键合电子吸引力更大,故氧元素非极性较强,故B正确;
C.单质状态属于物理性质,不能比较非金属性强弱,故C错误;
D.同主族自上而下非金属性减弱,故非金属性O>S,故D正确,
故答案为:>;C;
(3)X与Y可形成阳离子A为NH4+,检验NH4+离子的方法是:取溶液少许于试管中,向溶液中加入浓氢氧化钠溶液,加热,用湿润的红色石蕊试纸检验生成的气体,若试纸变蓝证明原溶液含有NH4+离子,
故答案为:取溶液少许于试管中,向溶液中加入浓氢氧化钠溶液,加热,用湿润的红色石蕊试纸检验生成的气体,若试纸变蓝证明原溶液含有NH4+离子;
(4)Y的气态氢化物为NH3,与氧气发生催化氧化生成NO与水,反应的化学方程式为:4NH3+5O2 $\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2 $\frac{\underline{催化剂}}{△}$4NO+6H2O;
(5)负极上Na失去电子,负极电极反应式为:Na-e-=Na+,正极上硫得电子发生还原反应,熔融状态下,Na2O和Al2O3能电离出阴阳离子而使电解质导电,且钠易和硫反应,所以它起到隔离作用,本质是Na与硫反应生成Na与硫形成的化合物,可以传导钠离子
故答案为:Na-e-=Na+;隔离正负极,传导钠离子;
(6)常温下向1000mL 0.2mol/L的H2S的气态氢化物水溶液中加入1.15g的Na的单质,Na的物质的量为$\frac{1.15g}{23g/mol}$=0.05mol,生成NaOH为0.05mol,H2S的物质的量为1L×0.2mol=0.2mol,发生反应:NaOH+H2S=NaHS+H2O,生成0.05mol NaHS,剩余H2S为0.2mol-0.05mol=0.15mol,为NaHS、H2S混合溶液.反应后溶液中由水电离的氢离子浓度为1×10-9<1×10-7,说明水的电离被抑制,则H2S电离程度大于HS-的水解程度,则c(HS-)>c(Na+),溶液呈酸性,由水电离得到氢氧根离子浓度1×10-9,则溶液中氢离子浓度为1×10-5,H2S的电离程度很小,则c(H2S)>c(HS-),c(Na+)>c(H+),溶液中氢离子源于水的电离、硫化氢电离、硫氢根离子电离,溶液中c(H+)>c(S2-),故溶液中离子浓度大小顺序为:c(H2S)>c(HS-)>c(Na+)>c(H+)>c(S2-),
故答案为:c(H2S)>c(HS-)>c(Na+)>c(H+)>c(S2-).
点评 本题考查较综合,涉及结构性质位置关系、元素周期律、电子式、离子检验、原电池、离子浓度大小比较等,侧重考查学生分析能力、知识迁移运用能力,需要学生具备扎实的基础,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 铁与氯化铁溶液反应:Fe+Fe3+═2Fe2+ | |
| B. | 氢氧化钡溶液与硫酸反应:OHˉ+SO42-+Ba2++H+═H2O+BaSO4 | |
| C. | 二氧化硅与氢氧化钠溶液反应:SiO2+OHˉ═H2SiO3 | |
| D. | 碳酸钙与盐酸反应:CaCO3+2H+═Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
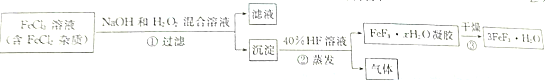
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| B | ||
| F |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
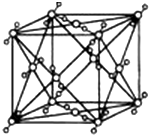 已知A、B、C、D、E都是周期表中的前四周期的元素,它们的核电荷数A<B<C<D<E.其中B、D、E原子最外层电子层的P能级(轨道)上的电子处于半充满状态.通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如右图所示.原子序数为31的元素镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一类半导体材料和GaE为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料.
已知A、B、C、D、E都是周期表中的前四周期的元素,它们的核电荷数A<B<C<D<E.其中B、D、E原子最外层电子层的P能级(轨道)上的电子处于半充满状态.通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如右图所示.原子序数为31的元素镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一类半导体材料和GaE为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | X | Y | Z |
| 初始浓度/mol•L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol•L-1 | 0.05 | 0.05 | 0.1 |
| A. | 反应达到平衡时,X的转化率为60% | |
| B. | 在25℃时,反应可表示为X+3Y═2Z,其平衡常数为1600 | |
| C. | 增大压强使平衡向生成Z的方向移动,平衡常数增大 | |
| D. | 升高温度此反应的平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 煤、石油中的硫元素燃烧时能生成SO2 | |
| B. | 动物尸体腐败过程产生的H2S气体会进入大气 | |
| C. | 循环过程中硫元素既发生氧化反应又发生还原反应 | |
| D. | 大气中的硫元素会全部转化成H2SO4随雨水降到土壤里 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吸热反应一定是反应物总能量大于生成物的总能量 | |
| B. | 常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 | |
| C. | 强电解质溶液导电能力一定很强,弱电解质溶液导电能力一定很弱 | |
| D. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
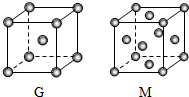 A、B、D、E、G、M六种元素位于元素周期表前四周期,原子序数依次增大.其中,元素A的一种核素无中子,B的单质既有分子晶体又有原子晶体,化合物DE2为红棕色气体,G是前四周期中电负性最小的元素,M的原子核外电子数比G多10.
A、B、D、E、G、M六种元素位于元素周期表前四周期,原子序数依次增大.其中,元素A的一种核素无中子,B的单质既有分子晶体又有原子晶体,化合物DE2为红棕色气体,G是前四周期中电负性最小的元素,M的原子核外电子数比G多10.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com