
【题目】在2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O反应中
(1) 是还原剂, 是还原产物。
(2) 该反应的离子方程式为: 。
(3) 用双线桥法表示此氧化还原反应电子转移的方向和数目
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
(4)NA表示阿伏伽德罗常数,若产生标准状况下的气体的体积为2.24 L,则反应过程中转移电子的数目为 ,被氧化的HCl的质量为 g。
【答案】(1)HCl,MnCl2
(2)MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O
(3)
(4)0.2NA;7.3g
【解析】
试题分析:(1)反应中氯元素的化合价从-1价升高到0价,失去1个电子,氯化氢是还原剂,氯气是氧化产物;Mn元素化合价从+7价降低到+2价,得到5个电子,高锰酸钾是氧化剂,氯化锰是还原产物;
(2)根据化学方程式可知反应的离子方程式为MnO4-+16H+ +10Cl-=2Mn2+ +5Cl2↑+8H2O。
(3)根据以上分析可知电子转移可表示为 。
。
(4)氯气的物质的量是0.1mol,转移0.2NA个电子。其中被氧化的氯化氢是0.2mol,质量是0.2mol×36.5g/mol=7.3g。


科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中进行氢气与碘(气态)合成HI的反应,下列说法能表明反应达到平衡的是
A.气体的平均分子量不再变化 B.反应的平衡常数不变
C.(H2) = 2 (HI) D.气体的颜色不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实,不能用氢键知识解释的是 ( )
A. 水分子高温下也很稳定
B. 水和乙醇可以完全互溶
C. 冰的密度比液态水的密度小
D. 液态氟化氢的化学式有时可以写成(HF)n的形式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的离子积常数随温度升高而升高。关于一定量的水,下列叙述正确的是
A. 温度升高,水中分子总数减少 B. 水中c(OH-)随温度升高而降低
C. 水的pH随温度升高而升高 D. 水的电离过程是放热过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH-=FeO42-+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42-,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只有在强碱性条件下稳定,易被H2还原。
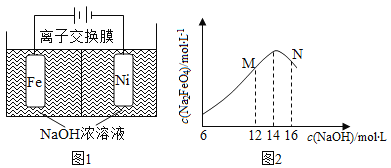
①电解一段时间后,c(OH-)降低的区域在__________(城 “阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因是________。
③c(Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、M、N四种金属,有如下相关信息,据此分析,这四种金属的活动性由强到弱的顺序是( )
① X + Y(NO3)2 = X(NO3)2 + Y
② X 与H2SO4(稀)不反应
③ M + H2SO4(稀) =MSO4 + H2↑
④ N + MSO4 = NSO4 + M
A. N>M>X>Y B. Y>X>M>N C. X>Y>M>N D.N>M>Y>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。下列叙述正确的是( )

A.反应开始到10 s末时,用Z表示的反应速率为0.158 mol·L-1·s-1
B.反应开始到10 s末时,X的物质的量浓度减少了0.79 mol·L-1
C.反应开始到10 s时,Y的转化率为79.0%
D.反应的化学方程式为X(g)+Y(g)![]() Z(g)
Z(g)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com