

| A.能将电能转换成化学能 |
| B.电子从碳棒经外电路流向铁棒 |
| C.碳棒发生氧化反应 |
| D.总反应为 Fe+H2SO4= FeSO4+H2↑ |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
 电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是
电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是 。电池的总反应可表示为:
。电池的总反应可表示为:
A.该电池工作时,正极反应为: |
B.锂电极作该电池负极,负极反应为: |
| C.该电池工作时,电子通过外电路从正极流向负极 |
| D.该电池组装时,必须在无水无氧条件下进行 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.Z金属可作为牺牲阳极保护法的阳极,保护Y金属 |
| B.Y金属不能从硫酸溶液中置换出氢气 |
| C.三种金属的活泼性顺序为:Z>X>Y |
| D.X和Y能构成电压最大的原电池 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.烧杯a中的溶液pH升高 | B.锌是化学电源的正极 |
| C.烧杯a中发生的反应为2H++2e-=H2↑ | D.盐桥中的阳离子向铁电极移动 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.碱性锌锰电池性能好于普通电池的原因是能反复使用 |
| B.碱性锌锰电池的正极是MnO2,当电池中有6.5g Zn反应时,将产生0.2molMnOOH |
| C.铅蓄电池放电时,负极的质量减少 |
| D.使用碱性电解质的氢氧燃料电池,负极的电极反应是H2 - 2e- = 2H+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 装置 | (Ⅰ)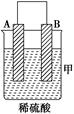 | (Ⅱ) | (Ⅲ) |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③⑤ | B.②④⑥ | C.④⑤⑥ | D.①②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com