
铜器久置,表面会生成一层绿色固体,为了解铜在空气中的腐蚀情况,某化学兴趣小组收集家中铜器表面的绿色固体进行探究。查阅相关资料后,猜想该绿色物质可能是铜的碳酸 盐。
盐。
该小组同学利用下图装置进行实验(部分夹持仪器略)。
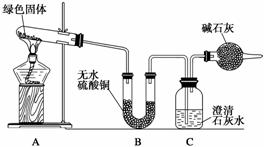
①对试管内的绿色固体进行加热,至完全分解,观察到A装置中绿色固体逐渐变成黑色,B装置中无水硫酸铜变成蓝色,C装置中澄清石灰水变浑浊。
②取少量加热后生成的黑色固体于试管中,加入稀硫酸,观察到黑色固体逐渐溶解,溶液变成蓝色。
③取少量上述蓝色溶液于试管中,浸入一根洁净的铁丝。
观察到铁丝表面有红色物质析出。
请回答下列问题:
(1)绿色固体中含有的元素是______________________________________________。
(2)加热后试管中剩余的黑色物质是________________________________________。
(3)假设该绿色物质是一种纯净物,则其化学式可能是________________________,加热分解的化学方程式为________________________________________________________
__________________________________________ ______________________________。
______________________________。
(4)上述实验步骤③中的反应的离子方程式为__________________________________
________________________________________________________________________。
(5)实验装置最后的干燥管的作用是_________________________________________。
(6)如果将B、C两装置对调,能否达到实验目的________(填“能”或“不能”),为什么?________________________________________________________________________
________________________________________________________________________。
答案 (1)Cu、H、O、C (2)CuO
(3)Cu2(OH)2CO3 Cu2(OH)2CO3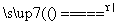 2CuO+H2O+CO2↑
2CuO+H2O+CO2↑
(4)Fe+Cu2+===Cu+Fe2+
(5)防止空气中的CO2进入广口瓶
(6)不能 因为对调后无法说明反应中有水生成
解析 根据无水硫酸铜变蓝,可知反应中有水生成,根据澄清石灰水变浑浊,可知有CO2生成,根据黑色固体溶于稀H2SO4,插入铁丝后有红色物质析出,知黑色物质应是CuO。若该绿色固体是纯净物,根据组成元素和各元素的化合价分析该物质应是碱式盐,化学式可能是Cu2(OH)2CO3。
(5)该实验装置中 最后的干燥管中装有碱石灰,目的是防止空气中的CO2进入广口瓶,干扰实验。
最后的干燥管中装有碱石灰,目的是防止空气中的CO2进入广口瓶,干扰实验。
(6)若将B、C对调,气体先通过石灰水,则无法证明绿色物质分解时是否有水生成。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
某温度时,在2 L的密闭容器中,X、Y、Z三种气态物质的量随时间的变化曲线如图所示。

(1)由图中所给数据进行分析,该反应的化学方程式为 ____________ ;
(2)反应从开始至2分钟末,用Y的浓度变化表示的平均反应速率为v(Y)= ;
(3)该反应开始时的压强与反应平衡时的压强之比为 ;
(4)X的转化率是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关金属的说法中,不正确的是 ( )
A.青铜、不锈钢、硬铝都是合金
B.铜表面易形成致密的氧化膜
C.工业上用电解熔融MgCl2的方法制取金属镁
D.铝是活泼金属,但在空气中耐腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
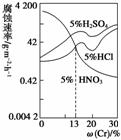 如图是三种稀酸对FeCr合金随Cr含量变化的腐蚀性实验结果,
如图是三种稀酸对FeCr合金随Cr含量变化的腐蚀性实验结果,
下列有关说法正确的是 ( )
A.稀硝酸对FeCr合金的腐蚀性比稀硫酸和稀盐酸的弱
B.稀硝酸和铁反应的化学方程式是Fe+6HNO3(稀)===Fe(NO3)3
+3NO2↑+3H2O
C.Cr含量大于13%时,因为三种酸中硫酸的氢离子浓度最大,
所以对FeCr合金的腐蚀性最强
D.随着Cr含量增加,稀硝酸对FeCr合金的腐蚀性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.pH=5.2的CH3COOH与CH3COONa混合溶液中,c(Na+)>c(CH3COO-)
B.在滴有酚酞溶液的氨水里加入盐酸至溶液恰好无色,则此时溶液的pH=7
C.若100 mL pH=11的NaOH溶液与10 mL盐酸混合后溶液的pH=7,则盐酸溶液的pH=2
D.某醋酸溶液的pH=3,将此溶液稀释10倍后溶液的pH=4
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实与结论(或推论)均正确的是( )
A.将浓氨水加到盛有AgCl固体的试管中,AgCl固体完全溶解,则所得溶液中c(Ag+)·c(Cl-)>Ksp(AgCl)
B.物质的量之比为1:2的Na2O2和NaHCO3的固体混合物,在密闭容器中充分加热反应后,残留的固体是Na2CO3
C.向FeBr2溶液中通入少量的氯气,再向反应后的溶液中滴加KSCN溶液,结果溶液变为红色,那么向FeI2溶液中通入少量的氯气,也会出现同样的现象
D.将某混合气体通入品红溶液中,溶液不褪色,该气体中无Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
铁及其化合物在日常生活、生产中应用广泛。氯化铁和高铁酸钾都是常见的水处理剂。下图为制备氯化铁及进一步氧化制备高铁酸钾的工艺流程。
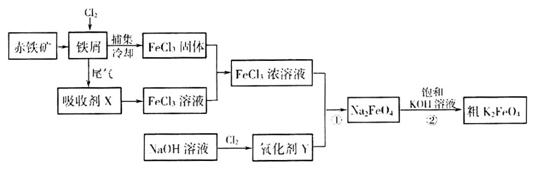 请回答下列问题
请回答下列问题
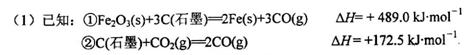
用赤铁矿为原料在高炉炼铁过程中发生的主要反应为
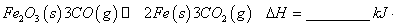 mol
mol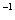 。
。
(2)吸收剂x的溶质为____________(写化学式)。
(3)氧化剂Y为“84消毒液”的有效成分,则在碱性条件下反应①的离子方程式为
__________________________________________________________________
(4)过程②是在某低温下进行的,反应的化学方程式为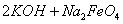 =
=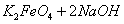 ,说明此温度下
,说明此温度下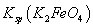 __________
__________ 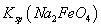 (填“>”或“<”)。
(填“>”或“<”)。
假定此过程中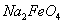 完全转化为
完全转化为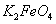 ,若最终制得粗产品
,若最终制得粗产品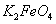 206.25t,产品纯度为96%,则理论上至少需要氧化剂Y的质量是___________t。
206.25t,产品纯度为96%,则理论上至少需要氧化剂Y的质量是___________t。
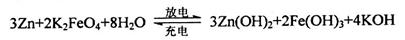 (5)高铁电池是一种新型二次电池,电解液为强碱溶液,其电池反应为:
(5)高铁电池是一种新型二次电池,电解液为强碱溶液,其电池反应为:
放电时电池的负极反应式为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
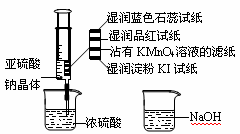
如图所示,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准),则下列有关说法正确的是
A.蓝色石蕊试纸先变红后褪色
B.NaOH溶液可用于除去实验中多余的SO2
C.湿润KI-淀粉试纸未变蓝,说明SO2的氧化性强于I2
D.品红试纸、沾有KMnO4溶液的滤纸均褪色,证明了SO2的漂白性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com