
分析 (1)由相同浓度亚硝酸、次氯酸电离常数可知,亚硫酸酸性比次氯酸强,根据强酸制备弱酸书写离子方程式;
(2)氨水呈弱碱性的原理分析羟胺呈弱碱性的原因;
(3)根据溶液的pH计算溶液中氢离子浓度,根据氢氧化钠的浓度计算氢氧根离子浓度,再结合Kw=c(H+).c(OH-)计算即可;
(4)热化学方程式和盖斯定律计算,(1)×3-(3)×2+(2)×2得到所需热化学方程式;
解答 解:(1)由相同浓度亚硝酸、次氯酸电离常数可知,亚硫酸酸性比次氯酸强,可能相互之间发生的离子互换反应的离子方程式为:HNO2+ClO-=NO2-+HClO,
故答案为:HNO2+ClO-=NO2-+HClO;
(2)羟胺和水反应生成[NH3OH]+和OH-,导致溶液中氢氧根离子浓度大于氢离子浓度而使溶液呈碱性,故答案为:NH2OH+H2O?NH3OH++OH-;
(3)0.01mol•L-1的NaOH溶液的pH为10,则氢离子浓度=10-10 mol/L,氢氧化钠是强电解质完全电离,所以溶液中氢氧根离子浓度是0.01mol/L,则Kw=c(H+).c(OH-)=0.01×10-10=1×10-12,
故答案为:1×10-12;
(4)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(1)2H2 (g)+O2 (g)=2H2O(g)△H=-483.6kJ/mol
(2)N2 (g)+2O2 (g)=2NO2 (g)△H=67.8kJ/mol
(3)N2 (g)+3H2 (g)=2NH3(g)△H=-92.0kJ/mol
依据热化学方程式和盖斯定律计算(1)×3-(3)×2+(2)×2得到NH3(g)燃烧生成NO2 (g)和H2O(g) 热化学方程式:4NH3(g)+7O2(g)?4NO2(g)+6H2O(g)△H=-1131.2kJ/mol;
故答案为:4NH3(g)+7O2(g)=4NO2(g)+6H2O(g)△H=-1131.2KJ/mol;
点评 本题考查了弱电解质电离平衡常数比较、离子积常数计算、溶液PH计算、热化学方程式书写方法和注意问题,主要是热化学方程式和盖斯定律的计算应用,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:实验题
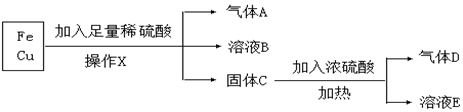
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O | |
| B. | 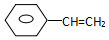 +4H2$\stackrel{一定条件}{→}$ +4H2$\stackrel{一定条件}{→}$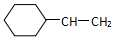 | |
| C. | 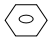 +HNO3$→_{△}^{浓硫酸}$ +HNO3$→_{△}^{浓硫酸}$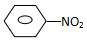 +H2O +H2O | |
| D. | CH4+Cl2 $\stackrel{光照}{→}$ CH3Cl+HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的产物仍能和溴水发生加成反应 | |
| B. | 该反应不属于加成反应,只属于聚合反应 | |
| C. | 该反应既是加成反应,也是聚合反应 | |
| D. | 该反应的生成物和反应物都属于高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醛量太少 | B. | 硫酸铜量少 | C. | NaOH量少 | D. | 加热时间短 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ③④⑤⑥⑦ | C. | ②③⑤⑥⑦ | D. | ①④⑤⑥⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com