
| A. | 铜溶于FeCl3溶液:3Cu+2Fe3+═3Cu2++2Fe | |
| B. | 碳酸钙溶于醋酸:CO32-+2H+═CO2↑+H2O | |
| C. | AlCl3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | Ba(OH)2溶液中加入过量NaHCO3溶液:Ba2++HCO3-+OH-═BaCO3↓+H2O |
分析 A.不符合反应客观事实;
B.醋酸为弱酸应保留化学式,碳酸钙为沉淀应保留化学式;
C.二者反应生成氢氧化铝沉淀和氯化铵;
D.碳酸氢钠过量反应生成碳酸钡、碳酸钠和水;
解答 解:A.铜溶于FeCl3溶液反应生成氯化亚铁和氯化铜,离子方程式:Cu+2Fe3+═Cu2++2Fe2+,故A错误;
B.碳酸钙溶于醋酸,离子方程式:CaCO3+2CH3COOH═CO2↑+H2O+Ca2++2CH3COO-,故B错误;
C.AlCl3溶液中加入过量氨水,离子方程式:Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故C正确;
D.Ba(OH)2溶液中加入过量NaHCO3溶液,离子方程式:Ba2++2HCO3-+2OH-═BaCO3↓+H2O+CO32-,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确物质的性质及化学式拆分原则,熟悉反应物用量对反应的影响是解题关键,选项D为易错选项.


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
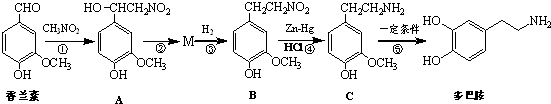
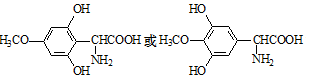 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ③⑤ | D. | ②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4种溶液pH的大小顺序:①>④>③>② | |
| B. | 等体积的①和②溶液混合后pH>7,c(NH3•H2O)>c( NH4+) | |
| C. | 溶液①、③由水电离产生的c(OH-):①<③ | |
| D. | 溶液③、④等体积混合后,溶液中c(CO32-)>c(HCO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤、石油、天然气均为化石燃料,它们属于可再生资源 | |
| B. | 大自然利用太阳能最成功的是植物的光合作用 | |
| C. | 石油的分馏、催化裂化、裂解等石油加工方法,其目的均为得到更多的汽油 | |
| D. | 化肥的大量使用不会造成环境污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2水,NaOH(aq) | B. | KMnO4(aq),氨水 | C. | H2O2溶液,氧化铜 | D. | HNO3(aq),氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | T(℃) | NO初始浓度(mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 280 | a | 5.80×10-3 | 124 |
| Ⅲ | 350 | 1.20×10-3 | 5.80×10-3 | b |
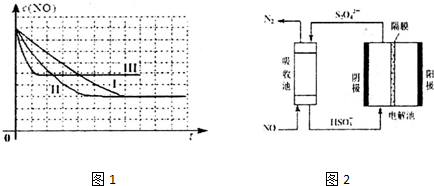
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9.2g甲酸中,所含化学键的数目为0.8 NA | |
| B. | 常温下,28g Fe与足量的浓硝酸反应,转移的电子数为1.5NA | |
| C. | 标准状况下,2.24LNH3和CH4的混合气体,所含电子总数为NA | |
| D. | 标准状况下,22.4L己烷所含有的分子数目为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com