
分析 加入过量的稀盐酸,有白色沉淀生成,溶液中一定有 Ag+;加入过量的稀硫酸,又有白色沉淀生成,滤液显酸性,故一定有 Ba2+;过滤,取少量滤液,滴入2滴KSCN溶液,没有明显的现象出现,故一定没有 Fe3+;加入NaOH溶液至溶液呈碱性,不能确定铝离子的存在.
解答 解:(1)加入过量的稀盐酸,有白色沉淀生成,溶液中一定有 Ag+;
(2)加入过量的稀硫酸,又有白色沉淀生成,滤液显酸性,故一定有 Ba2+;
(3)过滤,取少量滤液,滴入2滴KSCN溶液,没有明显的现象出现,故一定没有 Fe3+;
加入NaOH溶液至溶液呈碱性,不能确定铝离子的存在,
根据上述分析,待测液中一定含有的离子是 Ag+、Ba2+; 一定不含有的离子是Fe3+;不确定的离子为铝离子,可取步骤(2)的滤液加入过量的氨水,如有白色沉淀生成证明有Al3+,
故答案为:Ag+、Ba2+; Fe3+;取步骤(2)的滤液加入过量的氨水,如有白色沉淀生成证明有Al3+(其他可行方法亦可).
点评 本题考查常见阳离子检验,涉及了铵离子、氯离子、硫酸根检验方法,难度适中.


科目:高中化学 来源: 题型:选择题
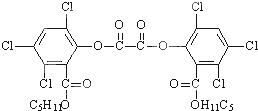
| A. | 1 mol草酸二酯与NaOH稀溶液反应(苯环上卤素不水解),最多可消耗10 mol NaOH | |
| B. | 草酸二酯水解时生成两种有机物 | |
| C. | 1 mol草酸二酯与H2完全反应,需要H2 6 mol | |
| D. | 草酸二酯的分子式为C26H22Cl6O8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某溶液中加入盐酸,产生的气体能使石灰水变浑浊,该溶液中一定含有CO32- | |
| B. | 某溶液中加入硝酸酸化的BaCl2,产生白色沉淀,该溶液中一定含有SO42- | |
| C. | 用洁净的铂丝蘸取某溶液在酒精灯上灼烧,产生黄色火焰,溶液中一定含Na+,一定不含K+ | |
| D. | 某溶液中加入NaOH溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,该溶液中一定含有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入HCl产生无色气体,将气体通入澄清石灰水中溶液变浑浊,说明一定有CO32- | |
| B. | 加入NaOH溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ | |
| C. | 加入AgNO3溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有Cl- | |
| D. | 加入BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
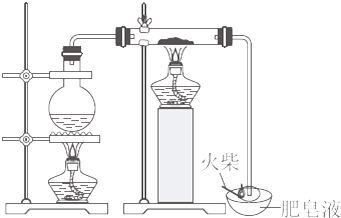
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
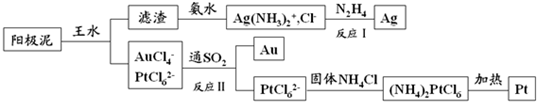
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将a molL-1 HCN溶液与a molL-1 NaOH溶液等体积混合,混合液中:c(OH-)>c(H+),c(Na+)>c(CN-) | |
| B. | 等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| C. | 冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小 | |
| D. | NaHCO3和Na2CO3混合液中,一定有c(Na+)+c(H+)═c(OH-)+c(HCO3-)+c(CO32-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com