
| A. | c(OH-)=1×10-7mol/L | B. | c(H+)=1×10-7mol/L | ||
| C. | c(OH-)=c(H+) | D. | pH=7 |
分析 溶液的酸碱性是根据溶液中氢离子浓度和氢氧根离子浓度的相对大小判断的,
当溶液中c(H+)>c(OH-)时,溶液呈酸性;
当溶液中c(H+)=c(OH-)时,溶液呈中性;
当溶液中c(H+)<c(OH-)时,溶液呈碱性,
注意不能根据溶液的pH值大小判断.
解答 解:A.温度不同溶液中离子积常数不同,c(OH-)=1×10-7mol/L不能说明溶液呈中性,故A错误;
B.温度不同溶液中离子积常数不同,c(H+)=1×10-7mol/L不能说明溶液呈中性,故B错误;
C.当溶液中c(H+)=c(OH-)时,溶液呈中性,故C正确;
D.常温下溶液PH=7说明溶液为中性,温度不同离子积常数不同,中性溶液PH不一定为7,故D错误;
故选C.
点评 本题考查溶液酸碱性的判断、溶液PH计算,该题是常识性知识的考查,难度不大,该题的关键是明确溶液酸碱性的判断依据,注意溶液的酸碱性是根据溶液中氢离子浓度和氢氧根离子浓度的相对大小判断的,本题有利于培养学生的逻辑推理能力和灵活应变能力.


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:实验题
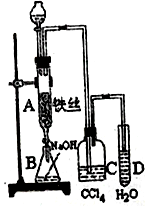 某学生在如图所示的装置中用苯和液溴制取溴苯,请根据下列实验步骤回答有关问题.
某学生在如图所示的装置中用苯和液溴制取溴苯,请根据下列实验步骤回答有关问题. ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚合物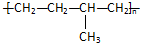 可由单体CH3CH=CH2和CH2=CH2加聚制得 可由单体CH3CH=CH2和CH2=CH2加聚制得 | |
| B. | 1 molCH3COOH与1mol CH3CH2OH在浓硫酸共热下生成的乙酸乙酯分子数为NA | |
| C. | 乙醇、苯酚、乙酸都有羟基,但是羟基上的H活泼性不同,主要是基团之间相互影响造成的 | |
| D. | 等物质的量的乙炔和乙醛分别充分燃烧,所耗用氧气的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol/L的甲酸溶液中氢离子浓度约为10-2 mol/L | |
| B. | 甲酸能与水以任意比互溶 | |
| C. | 10 mol/L甲酸恰好与10 mol/LNaOH溶液完全反应 | |
| D. | 在一定温度下,甲酸的导电性比盐酸溶液弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大于25mL | B. | 等于25mL | C. | 小于25mL | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 “盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为2Mg+O2+2H2O=2Mg (OH)2下列关于该电池的说法错误的是( )
“盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为2Mg+O2+2H2O=2Mg (OH)2下列关于该电池的说法错误的是( )| A. | Mg电极的电极反应式:Mg-2e-=Mg2+ | |
| B. | 这种电池的工作原理可以认为是镁的吸氧腐蚀 | |
| C. | 活性炭电极上发生氧化反应 | |
| D. | 电池工作时实现了化学能向电能的转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃).
表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃).| 电解质 | 电离方程式 | 电离常数K | Ksp |
| H2CO3 | H2CO3?HCO3-+H+ HCO3-?CO32-+H+ | K1=4.31×10-7 K2=5.61×10-11 | - |
| H3PO4 | H3PO4?H2PO4-+H+ H2PO4-?HPO42-+H+ HPO42-?PO43-+H+ | K1=7.52×10-3 K2=6.23×10-6 K3=2.20×10-13 | - |
| C6H5OH | C6H5OH?C6H5O-+H+ | 1.1×10-10 | - |
| NH3•H2O | NH3•H2O?OH-+NH4+ | 1.76×10-5 | - |
| BaSO4 | BaSO4(s)?Ba2++SO42- | - | 1.1×10-10 |
| BaCO3 | BaCO3(s)?Ba2++CO32- | - | 1×10-9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com