
����Ŀ�����Ļ�������;�㷺���ش��������⣺
��1����һ�������£������ܺ�ˮ������Ӧ���ɰ���������2N2��g����6H2O��g��=4NH3��g����3O2��g����H����÷�Ӧ��صĻ�ѧ�������������£�
��ѧ�� | N��N | H��O | N��H | O=O |
E��kJ/mol�� | 946 | 463 | 391 | 496 |
��÷�Ӧ����H��________kJ��mol-1��
��2���ں����ܱ������г���2 mol N2O5��1molO2������Ӧ4NO2 (g) + O2 (g) ![]() 2N2O5 (g) ��H��
2N2O5 (g) ��H��
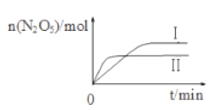
����֪�ڲ�ͬ�¶��²��N2O5�����ʵ�����ʱ��ı仯��ͼ��ʾ���÷�Ӧ����H_____0���������������������������������¸÷�Ӧ�������Է����У���ԭ����___________________��
�������йظ÷�Ӧ��˵����ȷ����_______�����ţ���
A���������������ƽ�����淴Ӧ�����ƶ������������ɫ����
B�����º��ݣ��ٳ���2 mol NO2��1molO2���ٴδﵽƽ��ʱ��NO2��ת��������
C�����º��ݣ��������ڵ��ܶȱ��ֲ���ʱ����Ӧ�ﵽ��ƽ��״̬
D�����÷�Ӧ��ƽ�ⳣ��������һ���ǽ������¶�
��3��N2O5��һ��������ɫ�����������Ʊ����������⻯��ȼ�ϵ������Դ�����õ�ⷨ�Ʊ��õ�N2O5������ԭ����ͼ��ʾ�������⻯��ȼ�ϵ�صĸ�����ӦʽΪ_________��

��4��X��Y��Z��W�ֱ���HNO3��NH4NO3��NaOH��NaNO2����ǿ������е�һ�֡��±��dz�����Ũ�Ⱦ�Ϊ0��01molL��1��X��Y��Z��W��Һ��pH����X��Y��Z��1molͬʱ����ˮ�еõ������Һ��������Һ�и����ӵ�Ũ���ɴ�С��˳��Ϊ________��
0��01molL��1����Һ | X | Y | Z | W |
pH | 12 | 2 | 8.5 | 4.5 |
��5�������������������ڴ����еĺ������������ʱ���漰���·�Ӧ��
I��2NO2(g)+NaCl(s) ![]() NaNO3 (s)+ClNO(g) K1
NaNO3 (s)+ClNO(g) K1
��2NO(g)+Cl2 (g) ![]() 2CNO(g) K2
2CNO(g) K2
��4NO2��g����2NaCl��s��![]() 2NaNO3��s����2NO��g����Cl2��g����ƽ�ⳣ��K��____����K1��K2��ʾ����
2NaNO3��s����2NO��g����Cl2��g����ƽ�ⳣ��K��____����K1��K2��ʾ����
���ں��������£���2L�����ܱ������м���0��2 mol NO��0��1 mol Cl2��10minʱ��Ӧ��ﵽƽ�⣬���10min��v(ClNO)��7.5��10-3molL-1min-1����ƽ��ʱNO��ת������1=____���������������䣬��Ӧ���ں�ѹ�����½��У�ƽ��ʱNO��ת������2__��1����������������������������
���𰸡�+1268 < �淴Ӧ�������S>0 BD BH4��+8OH�� 8e��= BO2��+6H2O c(Na+)>c(NO3)>c(NO2)>c(OH)>c(H+) ![]() 75% >
75% >
��������
��1���ɼ��������յ�������ȥ�¼������ͷŵ�����ֵ��Ϊ��Ӧ�ȣ�1mol N2����1mol N��N��1 mol H2����2 mol H-O��1mol NH3����3 mol N-H��������H=��Ӧ����ܼ���-��������ܼ��ܽ��м��㣻
��2���ٽ��ͼ1�����ȹ���ƽ��ֵ������ԭ���֪���¶Ȣ�<���ٸ���ͼ�����¶�����ʱN2O5���������仯���ж��¶�����ʱƽ���ƶ����ó���Ӧ�ʱ䣬�������� = ��H-T��S<0ʱ����Ӧ�ܹ��Է����У��ݴ˷�������
��
A. �������������ƽ�������ƶ����������Ũ�ȶ���С��
B. ���º����£��ٳ���2 mol NO2��1 mol O2���൱�ڼ�ѹ��ƽ�������ƶ���
C. ����������䣬�����������䣻
D. ����Ӧ���ȣ�����ƽ�������ƶ���
��3����ͼ2��֪��ԭ��ع���ʱNa+�������ƶ�����ԭ��ص����Ϊ������BH4���ڼ�����������������Ӧ����BO2����
��4��X��Y��Z��1 molL-1ͬʱ����ˮ���Ƶû����Һ����Һ�е�����Ϊ�����ʵ���Ũ�ȵ������ƺ��������ƣ�����������ˮ���ʹ��Һ�ʼ��ԣ���c��OH-��> c��H+���������Ӻ���������Ӷ���ˮ�⣬������ˮ���������������Ũ�ȴ�С��ϵ��c��Na+��>c��NO3-��>c��NO2-��>c��OH-��>c��H+����
��5������֪����2NO2��g��+NaCl��s��NaNO3��s��+ClNO��g����
��2NO��g��+Cl2��g��2ClNO��g����
���ݸ�˹���ɢ���2-��ɵã�4NO2��g��+2NaCl��s��2NaNO3��s��+2NO��g��+Cl2��g������÷�Ӧƽ�ⳣ��Ϊ�ٵ�ƽ�ⳣ��ƽ����ڵ��̣�
�ڲ��10min��v��ClNO��=7.5��10-3 molL-1min-1������n��ClNO��=7.5��10-3 molL-1min-1��10min��2L = 0.15 mol���ɷ���ʽ����μӷ�ӦNO�����������ʵ�������������ƽ��ʱ���������ʵ�����NO��ת���ʣ����ݵ�Ч˼���������
(1)��H=��Ӧ����ܼ���-��������ܼ���= 2��946 kJ/mol+12��463 kJ/mol 12��391 kJ/mol 3��496 kJ/mol = +1268 kJ/mol��
�ʴ�Ϊ��+1268��
(2)����ͼ1��֪���¶Ȣ�>�������¶�ʱ����ʱN2O5����������С��˵��ƽ�������ƶ���˵������Ӧ���ȣ�����H<0���÷�Ӧ������Ӧ���ȣ����淴Ӧ���ȣ���H>0�����淴Ӧ�ܹ��Է����У�������HT��S<0������Ҫ��S>0��
�ʴ�Ϊ��<���淴Ӧ�������S>0��
��
A. �����������������ƽ�������ƶ��������Ũ�ȶ���С�����������ɫ��dz����A�����
B. �÷�Ӧ������Ӧ������������������ٵķ����뿪ʼ���������ͬ���뷴Ӧ��Է�Ӧ���ת���ʵ�Ӱ�����ѹ��Ӱ����ͬ��ƽ�������ƶ�����Ӧ��ת��������B����ȷ��
C. �����������ܶ�ʼ�ղ��䣬�����ܶȲ��䲻��˵����Ӧ�ﵽƽ��״̬����C�����
D. �÷�ӦΪ���ȷ�Ӧ������ƽ�������ƶ�����ѧƽ�ⳣ������D����ȷ��
�ʴ�Ϊ��BD��
(3)��ͼ2��֪�����⻯��ȼ�ϵ�ص����Ϊ������BH4���ڼ�����������������Ӧ����BO2�����缫��ӦʽΪ��BH4��+8OH�� 8e��= BO2��+6H2O��
�ʴ�Ϊ��BH4��+8OH�� 8e��= BO2��+6H2O��
(4)X��Y��Z��1molL1ͬʱ����ˮ���Ƶû����Һ����Һ�е�����Ϊ�����ʵ���Ũ�ȵ������ƺ��������ƣ�����������ˮ���ʹ��Һ�ʼ��ԣ���c(OH)>c(H+),�����Ӻ���������Ӷ���ˮ�⣬������ˮ���������������Ũ�ȴ�С��ϵ��c(Na+) > c(NO3) > c(NO2) > c(OH) > c(H+)��
�ʴ�Ϊ��c(Na+)>c(NO3)>c(NO2)>c(OH)>c(H+)��
(5) I��2NO2(g)+NaCl(s) ![]() NaNO3 (s)+ClNO(g) K1
NaNO3 (s)+ClNO(g) K1
��![]() 2CNO(g) K2
2CNO(g) K2
���ݸ�˹���ɣ�����2��ɵ�4NO2��g��+2NaCl��s��2NaNO3��s��+2NO��g��+Cl2��g������÷�Ӧƽ�ⳣ��K = ![]() ��
��
�ʴ�Ϊ��![]() ��
��
(2)���10min��v (ClNO) = 7.5��103 molL1min1������n(ClNO) = 7.5��103molL1min�� 10 min �� 2 L = 0.15 mol��
�ɷ���ʽ��֪���μӷ�Ӧ���������ʵ���Ϊ0.15 mol��![]() = 0.075 mol����ƽ��ʱ���������ʵ���Ϊ0.1 mol 0.075 mol = 0.025 mol��
= 0.075 mol����ƽ��ʱ���������ʵ���Ϊ0.1 mol 0.075 mol = 0.025 mol��
�μӷ�ӦNO���ʵ���Ϊ0.15 mol����NO��ת����Ϊ![]() �� 100% = 75 %��
�� 100% = 75 %��
����ӦΪ�������ʵ�����С�ķ�Ӧ�����º����������£�����ƽ��ʱѹǿ����ʼѹǿС�������������ֲ��䣬��Ӧ(��)�ں�ѹ�����½���,��ЧΪ�ں��º����µ�ƽ�����������ѹǿ��ƽ�������ƶ���NOת��������ת������2 > ��1��
�ʴ�Ϊ��75%��>��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ����100mL0.100molL��1Na2CO3��Һ�ļ����ؼ�ʵ�鲽��Ͳ�������ͼ�ش��������⣺
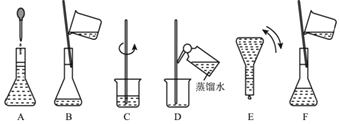
��1��������ƿ����һ�����ʵ���Ũ�ȵ���Һ��������ƿ������_____��
������� ��ƿ����©ˮ�� ���������Ƶ���Һ��ϴ���� �������������Ҫ���
��2������Na2CO310H2O��������Һ����Ҫ��������_____�ˡ�������ȡ�ľ����Ѿ���һ����ʧȥ�˽ᾧˮ���������Ƶ���ҺŨ��ƫ_____�������/С����
��3��д��������Һ������Ҫ�õ��IJ������������ƣ��ձ���_____��
��4������Bͨ����Ϊת�ƣ�����Aͨ����Ϊ_____������D��Ϊ_____����û�в���D�������Ƶ�Ũ��ƫ_____�������/С������
��5��������ʵ�鲽��A��F��ʵ������Ⱥ��������_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������PbSO4��PbCO3���ܶȻ������ֱ�Ϊ1.7��![]() ��7.4��
��7.4��![]() ������˵���������
������˵���������
A. PbSO4�ı�����Һ�У�c(Pb2+)ԼΪ1.3��![]()
![]()
B. ��ӦPbSO4(s)+CO32-(aq) ![]() PbCO3(s)+SO42-(aq)��ƽ�ⳣ��ԼΪ4.4��
PbCO3(s)+SO42-(aq)��ƽ�ⳣ��ԼΪ4.4��![]()
C. ��c(CO32-)=c(SO42-)�Ļ��Һ�еμ�Pb(NO3)2��Һ���ȵõ�PbCO3����
D. PbCO3��ˮ�е��ܽ�ȱ���Pb(NO3)2��Һ�еĴ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ�к��ж��ֳɷ֣�������ж������ʣ�������ˮ�ֱ�����ͼ������������(������������ˮ���غϲ��ִ������ʼ�ķ�Ӧ������ˮ����)����ش��������⣺
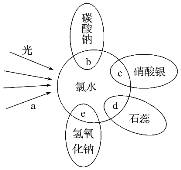
��1����֤����ˮ����Ư���Ե���___(�a����b����c����d����e��)��
��2����Ӧc�����е�������___����Ӧe�Ļ�ѧ����ʽΪ___����Ӧb�Ļ�ѧ����ʽΪ___��
��3�����õ���ˮ���ջ���___���û�ѧ��Ӧ����ʽ��ʾΪ___��
��4��ʵ���ұ�����ˮ�ķ�����___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����˫���ű�����з�Ӧ�е���ת�Ƶķ������Ŀ����ָ���������ͻ�ԭ����
(1) Cl2 + SO2 + 2H2O = H2SO4 + 2HCl_______������_______����ԭ��______��
(2)2Fe��3Cl2![]() 2FeCl3_______������______����ԭ��_______��
2FeCl3_______������______����ԭ��_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��ʯ���ѽ�������Ҫ�ɷ�֮һ����AΪԭ���Ʊ�ҩ���м���X�ĺϳ�·�����£�
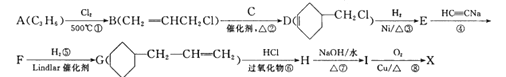
��֪i.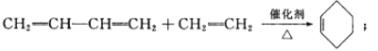
ii.![]() ��
��
�ش�����ͬ�⣺
��1��A�Ľṹ��ʽΪ_________��B������Ϊ__________��D�к��еĹ����ŵ�������___________��
��2���л���I�Ľṹ��ʽΪ___________����Ӧ�ܵķ�Ӧ������___________��
��3����A����B�Ļ�ѧ����ʽΪ______________________________________��
��4����Ӧ��Ļ�ѧ����ʽΪ___________________________________________��
��5����������������X��ͬ���칹����___________�֡�
i.�ܷ���������Ӧ��
ii.������Ԫ���ṹ��
iii.��Ԫ������2��ȡ������
���к˴Ź�����������6��壬�ҷ����֮��Ϊ4��4��3��2��2��1���л���Ľṹ��ʽΪ________����дһ�֣���
��6������F�ĺϳ�·�ߣ���CH3CH=CHCH3Ϊԭ������Ʊ� �ĺϳ�·�ߣ�__________�������Լ���ѡ)��
�ĺϳ�·�ߣ�__________�������Լ���ѡ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������һ��������������£�����Ч�����ȩ�������л��Ч���־ã�����������������ij�������о�����Һ������Զ�TiO2���Ⱦ��R���ⷴӦ��Ӱ�죬�����ͼ��ʾ�������ж���ȷ����
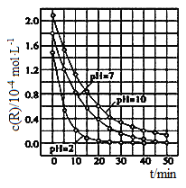
A. ��0��20min֮�䣬pH��7ʱR�Ľ�������Ϊ0.07mol��L-1��min-1
B. R����ʼŨ�Ȳ�ͬ�����ж���Һ������Զ�R�Ľ������ʵ�Ӱ��
C. �������Ѷ�pH��2��R��Һ��Ч�ʺ�
D. ��0��50 min֮�䣬R�Ľ���ٷ���pH��2����pH��7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ȷ���(H)��һ�����͡�ǿЧ���ȡ���ʹ�����ؽ���ҩ���ϳ�·�����£����ַ�Ӧ����ʡ�ԣ���
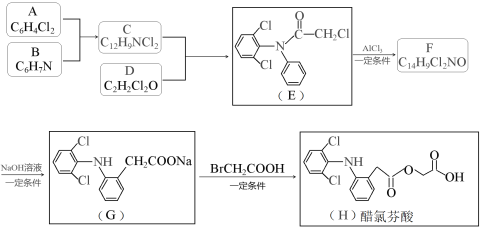
��֪��

��ش�
��1��������F�Ľṹ��ʽ��__________________��
��2��д��C+D��E�Ļ�ѧ����ʽ____________________________________________��
��3������˵������ȷ����__________��
A��������A������ԭ�ӿ϶�����ͬһƽ��
B��������B�����
C��������E��NaOH��Һ��Ӧ�������4molNaOH
D�����ȷ������ʽΪC16H12Cl2NO4
��4����֪C��ͬ���칹���ж��֣�д��ͬʱ������������������ͬ���칹��Ľṹ��ʽ_______��
��IR�ױ��������к������������ṹ����2����ԭ�Ӳ���ͬһ�������ϣ�
��1H-NMR����ʾֻ��5�ֲ�ͬ��������ԭ��
��5������Ա�����ϩΪԭ�Ϻϳ� ![]() ��·��(������ͼ��ʾ�����Լ���ѡ)��
��·��(������ͼ��ʾ�����Լ���ѡ)��
______________________________________________________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪:H2(g)+I2(g)![]() 2HI(g)��H=-14.9kJ��mol-1��ij�¶��£��������Ϊ2.0L�ļס������������ܱ������г��뷴Ӧ�����ʼ���ʵ������±���ʾ�����з�Ӧ�ﵽƽ��ʱ�����c(H2)=0.008mol��L-1�������ж���ȷ���ǣ� ��
2HI(g)��H=-14.9kJ��mol-1��ij�¶��£��������Ϊ2.0L�ļס������������ܱ������г��뷴Ӧ�����ʼ���ʵ������±���ʾ�����з�Ӧ�ﵽƽ��ʱ�����c(H2)=0.008mol��L-1�������ж���ȷ���ǣ� ��
��ʼ���ʵ��� | n(H2)/mol | n(I2)/mol | n(HI)/mol |
�� | 0.02 | 0.02 | 0 |
�� | 0.04 | 0.04 | 0 |
A. ƽ��ʱ������H2��ת�����Ǽ��е�2��
B. ƽ��ʱ�����л�������ɫ��������
C. ƽ��ʱ���ס����������ı仯ֵ���
D. ���¶��£���Ӧ��ƽ�ⳣ��K=0.25
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com